OF2是V字形分子,氧原子成键的轨道类型是()A、2个P轨道B、sp杂化C、sp3不等性杂化D、sp2杂化
题目
OF2是V字形分子,氧原子成键的轨道类型是()
- A、2个P轨道
- B、sp杂化
- C、sp3不等性杂化
- D、sp2杂化
相似考题
参考答案和解析
更多“OF<sub>2</sub>是V字形分子,氧原子成键的轨道类型是”相关问题
-
第1题:
在OF2分子中,氧原子成键的杂化轨道是下列中哪种杂化轨道?A. sp3杂化
B. sp杂化
C.sp2杂化
D.sp3不等性杂化答案:D解析:提示:考查如何判断中心原子的杂化类型。 -
第2题:
按照量子力学原理,以及共价键的成键原则,阐述原子轨道组合成分子轨道的原则?
正确答案: ⑴能量近似原则:只有能量相近(包括相等、相同)的原子轨道才可以组合。
⑵最大重叠原则:因为形成共价键时,只有轨道最大限度的重叠,才可以使体系的能量降低最多,体系趋于稳定。
⑶对称性原则:原子轨道的组合是核外电子运动的波函数的组合,按照共价键的成键原则,必须波函数位相相同的轨道才可以重叠成键,所以,轨道的组合必须对称性允许。 -
第3题:
关于原子轨道的说法正确的是()
- A、凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体.
- B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;
- C、sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;
- D、凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键.
正确答案:C -
第4题:
凡是配位数为4的分子,其中心原子均采用sp3杂化轨道成键。
正确答案:错误 -
第5题:
BF3分子使用()杂化轨道成键,所以分子构型为();而NF3分子使用()杂化轨道成键,所以分子构型是()。
正确答案:sp2;三角形;不等性sp3;三角锥形 -
第6题:
原子间成键时,同一原子中能量相近的某些原子轨道要先杂化,其原因是()
- A、保持共价键的方向性;
- B、进行电子重排
- C、增加成键能力;
- D、使不能成键的原子轨道能够成键.
正确答案:C -
第7题:
R1、R2两电阻并联,R1上的分流I=()。
- A、V/R<sub>1</sub>
- B、V/R<sub>2</sub>
- C、V/R<sub>1</sub>+R<sub>2</sub>
正确答案:A -
第8题:
分析下列各分子的中心原子的杂化轨道类型和指出各化学键的键型(σ键或π键)。 (1)HCN中三个原子在一条直线上; (2)H2S中三个原子不在一条直线上。
正确答案: (1)是sp杂化,σ键和π键
(2)是sp3杂化,σ键 -
第9题:
单选题用HCl滴定NaOH和Na2CO3混合液,首先加入用酚酞指示剂,消耗HCl体积V1,之后用甲基橙指示剂,消耗HCl体积V2,则V1和V2的关系是:AV<sub>1</sub>>V<sub>2 </sub> </p>
BV<sub>1</sub><V<sub>2</sub> </p>
CV<sub>1</sub>=V<sub>2</sub> </p>
D不能确定
正确答案: B解析: -
第10题:
单选题下列分子中,中心原子不是采用sp3d杂化轨道成键的是( )。AXeF2
BClF3
CSF4
DIF5
正确答案: B解析:
I原子的最外层电子排布为5s25p5,IF5中心原子I采用的是sp3d2杂化轨道类型与5个F原子成键。 -
第11题:
单选题A<p>I<sub>2</sub>=I<sub>3</sub></p>
B<p>I<sub>2</sub>=4I<sub>3</sub></p>
C<p>I<sub>2</sub>=2I<sub>3</sub></p>
D<p>I<sub>3</sub>=4I<sub>2</sub></p>
正确答案: D解析: -
第12题:
填空题水是食品的重要组成成成分,其H2O分子中氧原子的()个价电子参与杂化,形成()个()杂化轨道,分子有()体构型,两个H-O键之间的夹角为()。正确答案: SP3,109,5°解析: 暂无解析 -
第13题:
在下列物质的分子中,中心原子采用sp杂化轨道成键,分子空间构型是直线型的是( )。A.
B.
C.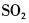
D.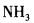 答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。
答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。 -
第14题:
H2O2分子中,氧原子用下列哪一种杂化轨道成键()
- A、sp
- B、sp2
- C、sp3
- D、dsp2(sp2d)
正确答案:C -
第15题:
SnCl2分子和H2O分子的空间构型均为V型,表明它们的中心原子采取相同方式的杂化轨道成键。
正确答案:错误 -
第16题:
按照杂化轨道理论,在CH4分子中,C原子采用sp3杂化轨道与H原子的1s轨道成键,形成一个空间构型为正四面体的分子。H2O分子中O原子用不等性sp3杂化轨道成键,分子的几何构型是()。
正确答案:V字型 -
第17题:
水是食品的重要组成成成分,其H2O分子中氧原子的()个价电子参与杂化,形成()个()杂化轨道,分子有()体构型,两个H-O键之间的夹角为()。
正确答案:SP3;109;5° -
第18题:
在OF2分子中,氧原子成键的杂化轨道是下列中哪种杂化轨道?()
- A、sp3杂化
- B、sp杂化
- C、sp2杂化
- D、sp3不等性杂化
正确答案:D -
第19题:
PCl3分子中,与Cl原子成键的中心原子P采用的原子轨道是:()
- A、px,py,pz
- B、三个sp杂化轨道
- C、三个sp2杂化轨道
- D、三个sp3杂化轨道
正确答案:D -
第20题:
单选题变直径圆管流,细断面直径d1,粗断面直径d2=2d1,粗细断面雷诺数的关系是( )。A<p>Re<sub>1</sub>=0.5Re<sub>2</sub></p>
B<p>Re<sub>1</sub>=Re<sub>2</sub></p>
C<p>Re<sub>1</sub>=1.5Re<sub>2</sub></p>
D<p>Re<sub>1</sub>=2Re<sub>2</sub> </p>
正确答案: D解析: 暂无解析 -
第21题:
问答题按照量子力学原理,以及共价键的成键原则,阐述原子轨道组合成分子轨道的原则?正确答案: ⑴能量近似原则:只有能量相近(包括相等、相同)的原子轨道才可以组合。
⑵最大重叠原则:因为形成共价键时,只有轨道最大限度的重叠,才可以使体系的能量降低最多,体系趋于稳定。
⑶对称性原则:原子轨道的组合是核外电子运动的波函数的组合,按照共价键的成键原则,必须波函数位相相同的轨道才可以重叠成键,所以,轨道的组合必须对称性允许。解析: 暂无解析 -
第22题:
单选题酶促反应速度(v)达到最大反应速度(Vmax)的80%时,底物浓度[S]为A<p>1K<sub>m</sub></p>
B<p>2K<sub>m</sub></p>
C<p>3K<sub>m</sub></p>
D<p>4K<sub>m</sub></p>
E<p>5K<sub>m</sub></p>
正确答案: E解析: -
第23题:
单选题H2S分子中,S原子成键的杂化轨道类型为( )。Asp3杂化
Bsp杂化
Csp2杂化
Dsp3不等性杂化
正确答案: C解析:
S原子(价电子构型为3s23p4)在成键过程中,有1个3s轨道和3个3p轨道组合成sp3不等性杂化轨道。因为其中2个sp3杂化轨道已为孤对电子所占据,其余2个不等性sp3杂化轨道和2个H原子的1s轨道重叠,形成2个S—H σ键。
