相同质量的铝与锌分别和足量的盐酸完全反应生成的氢的质量也相同。()此题为判断题(对,错)。
题目
相同质量的铝与锌分别和足量的盐酸完全反应生成的氢的质量也相同。()
此题为判断题(对,错)。
相似考题
更多“相同质量的铝与锌分别和足量的盐酸完全反应生成的氢的质量也相同。() ”相关问题
-
第1题:
将Mg;Al;Zn分别放入相同溶质质量分数的盐酸中,反应完全后,放出的氢气质量相同,其可能原因是( )
A.放入的三种金属质量相同,盐酸足量;
B.放入的Mg;Al;Zn的质量比为12:18:32.5,盐酸足量;
C.盐酸质量相同,放入足量的三种金属;
D.放入盐酸的质量比为3:2:1,反应后无盐酸剩余。
正确答案:C
-
第2题:
足量盐酸与250g碳酸钙反应,生成二氧化碳的质量是多少?
解:设可以生成二氧化碳的质量为x。 CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 44 250g x 100/44=250g/x x=110g 答:可以生成二氧化碳110g 。 -
第3题:
用同一NaOH溶液,分别与相同体积的盐酸、醋酸溶液反应,完全反应后消耗了相同量的NaOH溶液.由此说明该盐酸和醋酸溶液的关系是( )A.H+浓度相同
B.物质的量浓度相同
C.溶质的质量分数相同
D.pH相同答案:B解析:【解题指要】 (1)首先应明确盐酸、醋酸溶液分别与NaOH溶液反应,消耗NaOH溶液的量与盐酸、醋酸溶液中所含溶质的量成正比. 从反应方程式中可知它们的质量比和物质的量之比.
由此可知,若消耗NaOH溶液的量相等,则盐酸、醋酸溶液中所含溶质的物质的量一定相等,但质量一定不等,即n(HCl)=n(CH3COOH),m(HCl)≠m(CH3COOH).
质的量浓度相等.故B选项正确.
因不知溶液的总质量,所以溶质的质量分数一般不同,即C选项错误.
(2)其次,应知道盐酸是强酸,醋酸是弱酸,它们的电离程度不同.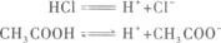
当HCl、CH3COOH的物质的量相同时,溶液中H+的物质的量一定不同,即H+的物质的量浓度一定不同.所以A选项错误.
(3)根据pH=-lg c(H+)可知,H+浓度不同,溶液的pH也一定不同,即溶液的酸性强弱不同.所以D选项也错误. -
第4题:
一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量.答案:解析:题目中涉及的化学反应如下: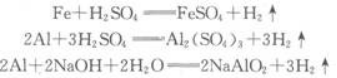

答:原混合物中铝的质量为5.4g,铁的质量为5.6g. -
第5题:
某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质量与反应时间有下图所示关系。
分析图像得到的以下结论中,不合理的是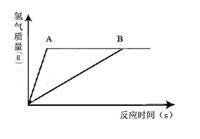 A.反应得到氢气的质量相等
A.反应得到氢气的质量相等
B.反应后所得溶液的质量分数A>B
C.两种金属的活动顺序A>B
D.稀硫酸已完全反应,两种金属可能有剩余答案:B解析: -
第6题:
如果相同质量的同种燃料不完全燃烧时仅产生CO,在相同的过量空气系数下不完全燃烧生成的烟气与完全燃烧生成的烟气相比,()
- A、总烟气容积增加,烟气中的氧气容积增加
- B、总烟气容积减少,但烟气中的氧气容积增加
- C、总烟气容积相同,但烟气中的氧气容积增加
- D、总烟气容积相同,且烟气中的氧气容积相同
正确答案:A -
第7题:
将Mg、Al、Zn分别放入相同溶质质量分数的盐酸中,反应完全后,放出的氢气质量相同,其可能原因是()
- A、放入的三种金属质量相同,盐酸足量
- B、放入的Mg、Al、Zn的质量比为12:18:32.5,盐酸足量
- C、盐酸质量相同,放入足量的三种金属
- D、放入盐酸的质量比为3:2:1,反应后无盐酸剩余
正确答案:C -
第8题:
利用沉淀反应进行质量分析时,要求沉淀式和称量式()。
- A、完全相同
- B、完全不同
- C、可以相同,也可以不同
- D、相对分子质量要小
正确答案:C -
第9题:
利用沉淀反应进行重量分析时,要求沉淀形式和称量形式()。
- A、完全相同
- B、完全不同
- C、可以相同,也可以不同
- D、相对分子质量要小
正确答案:C -
第10题:
填空题钠、镁、铝分别与足量的盐酸反应,在相同状况下产生的氢气的体积相等,则钠、镁、铝三种金属的物质的量之比为____.正确答案: 6∶3∶2解析:
三个反应中金属与氢气的对应比例分别为2Na~H2,Mg~H2,2Al~3H2,所以当氢气的量相同时,钠、镁、铝三种金属的物质的量之比=2∶1∶(2/3)=6∶3∶2. -
第11题:
单选题相同质量的下列物质,分别与足量盐酸反应,放出CO2最多的是( ).ACa(HCO3)2
BNa2CO3
CNaHCO3
DCaCO3
正确答案: C解析:
相同质量的4种物质与足量盐酸反应,与生成物CO2的关系分别为Ca(HCO3)2~81~44;Na2CO3~106~44;NaHCO3~84~44;CaCO3~100~44;故Ca(HCO3)2放出CO2最多. -
第12题:
单选题用浓度和质量都相同的两份盐酸分别与足量的碳酸钙和碳酸镁反应,则生成二氧化碳的质量正确的是()A碳酸钙多
B碳酸镁多
C相同
D无法比较
正确答案: C解析: 暂无解析 -
第13题:
锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5g锌与足量盐酸反应,可
制得氢气和氯化锌的质量各是多少?
解:设制得H2的质量为x,ZnCl2 的质量为y。 Zn+2HCl=ZnCl2+H2↑ 65 136 2 6.5 g y x x=6.5g×2/65=0.2g y=136×6.5g/65=13.6g 答:可制得H2的质量约为0.2 g,ZnCl2的质量约为13.6 g。 -
第14题:
镁、锌、铁三种金属各30g,分别与足量盐酸反应,生成氢气的质量各是多少?如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
生成氢气的质量:Mg: 2.5g, Zn: 0.92g, Fe: 1.07g 需要金属的质量:Mg: 360g, Zn: 975g, Fe: 840g -
第15题:
在相同条件下,0.1molZn和0..1molAl分别跟足量的稀盐酸反应,哪个反应放出的氢气多答案:解析:锌和铝分别跟稀盐酸反应的化学方程式是

答:
-
第16题:
如图所示,天平左右两端的烧杯中有等量稀盐酸,并处于平衡状态。现在天平左右两端的烧杯中,分别加入相同质量的锌块与铜块,结果发现天平右侧缓慢下降,主要的原因是( )。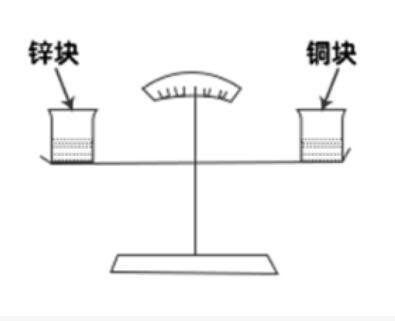 A.相同质量的铜块与锌块大小不同
A.相同质量的铜块与锌块大小不同
B.铜块与稀盐酸反应产生了氯化铜
C.锌块与稀盐酸反应产生了氢气
D.化学反应产生了大量水蒸气答案:C解析:第一步,确定题型。
本题考查化学反应。
第二步,根据天平的状态进行分析。
①初始:天平两端有等量稀盐酸,并处于平衡状态。
②过程:相同质量的锌块与铜块分别加入天平左右两端。
③结果:天平右侧(铜块)缓慢下降。
第三步,分析选项。
A项:天平是称质量的,整体的上升和下降只与物体的质量有关系,与体积没有关系,排除;
B项:铜块与稀盐酸不反应,排除;
C项:锌块和稀盐酸反应产生了氢气,质量变轻,符合;
D项:铜块不与稀盐酸发生反应,锌块和稀盐酸反应产生氢气,不是水蒸气,排除。
因此,选择C选项。 -
第17题:
在相同条件下,等量的()金属与足量盐酸反应生成H2的量最少。
- A、镁
- B、铝
- C、钾
正确答案:C -
第18题:
已知镁、铝、铁的相对原子质量分别为24、27、56。镁、铝、铁三种金属,分别和同浓度同体积的盐酸反应,同温同压下产生相同体积的氢气,则参加反应的金属()
- A、物质的量相等
- B、质量相等
- C、所失去的电子数相等
- D、质量比为24/27/56
正确答案:C -
第19题:
1moL锌分别与足量的一元酸、二元酸和三元酸进行反应,所生成氢气的体积比为1﹕2﹕3。
正确答案:错误 -
第20题:
测量一定质量的铝锌合金与强酸溶液反应产生氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:中学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g/cm3)、水. 补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略). ①________________________________________________________________________ ②________________________________________________________________________ ③________________________________________________________________________ ④________________________________________________________________________
正确答案:①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗扣在样品上面.
②往烧杯中注入水,直到水面没过漏斗颈(没答水面没过漏斗颈不得分).
③在100mL量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡).
④将长颈漏斗(或玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生. -
第21题:
用浓度和质量都相同的两份盐酸分别与足量的碳酸钙和碳酸镁反应,则生成二氧化碳的质量正确的是()
- A、碳酸钙多
- B、碳酸镁多
- C、相同
- D、无法比较
正确答案:C -
第22题:
单选题下列对于淀粉和纤维素的叙述中,正确的是()A互为同分异构体
B化学性质完全相同
C碳、氢、氧元素的质量比完全相同
D结构相同
正确答案: B解析: 暂无解析 -
第23题:
填空题分解____g氯酸钾放出的氧气恰好跟16.4g锌与足量的盐酸反应放出的氢气完全化合.正确答案: 10.2解析:
由最终的得失电子守恒可知,锌和氯酸钾的物质的量之比为3:1,由题意能求出锌的物质的量.
