在300K、101.325kPa下,有一原电池的电动势E为2V,若在该温度、压力下,原电池向环境可逆输出了2F的电量,则此原电池对环境做了()的电功。A.385.94kJ B.-385.94kJ C.-4kJ D.-192.97kJ
题目
B.-385.94kJ
C.-4kJ
D.-192.97kJ
相似考题
更多“在300K、101.325kPa下,有一原电池的电动势E为2V,若在该温度、压力下,原电池向环境可逆输出了2F的电量,则此原电池对环境做了()的电功。”相关问题
-
第1题:
已知原电池反应:Cu(s)+Cl2(g)=Cu2+(aq)+2Cl-(aq)。当增大Cl2(g)压力,原电池的电动势变_______;当增大Cu2+(aq)浓度,原电池的电动势变__________。
A、增加,减小
B、增加,增加
C、减小,增加
D、减小,减小
参考答案:A
-
第2题:
向原电池 的负极中加入NaCl,则原电池电动势的变化是:
A.变大
的负极中加入NaCl,则原电池电动势的变化是:
A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示:负极氧化反应:Ag+Cl-=AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl- = AgCl
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,则电池的电动势增大。 -
第3题:
向原电池(-)Ag,AgCl Cl- Ag+ Ag(+)的负极中加入NaCl,则原电池电动势的变化是:A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示 负极氧化反应:Ag+Cl- =AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl-=AgCl
原电池负极能斯特方程式为: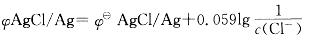
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,
则电池的电动势增大。 -
第4题:
已知φθAg+/Ag=0.80V,φθZn2+/Zn=-0.76V。将两电对组成原电池,该原电池的标准电动势为()
- A、2.36V
- B、0.04V
- C、0.84V
- D、1.56V
正确答案:D -
第5题:
下列说法中错误的是()。
- A、原电池正极发生还原反应,负极发生氧化反应
- B、原电池中氧化剂在原电池的正极
- C、原电池的电池反应就是作为氧化剂的物质同作为还原剂的物质起反应
- D、原电池中,电极电位较低的电对组成电池的正极
正确答案:D -
第6题:
两电对组成一原电池,则电极电位高的是()极,其上发生()反应。
正确答案:正;还原 -
第7题:
将反应 Fe3++Cu=Fe2++Cu2+ 组成原电池,在铜半电池中加入氨水,则原电池的电动势会()
- A、减小
- B、增加
- C、不变
- D、先减小后增加
正确答案:B -
第8题:
电位分析法中,分析钾离子活度(pK值),依据的是()
- A、原电池电动势与K+浓度成线形关系
- B、原电池电动势与K+活度成线形关系
- C、原电池电动势与K+浓度对数成线形关系
- D、原电池电动势与K+活度对数成线形关系
正确答案:C -
第9题:
(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第10题:
单选题(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第11题:
单选题向原电池(-)Ag、的负极中加入NaCl,则原电池电动势变化是()。A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第12题:
单选题电位分析法中,分析钾离子活度(pK值),依据的是()A原电池电动势与K+浓度成线形关系
B原电池电动势与K+活度成线形关系
C原电池电动势与K+浓度对数成线形关系
D原电池电动势与K+活度对数成线形关系
正确答案: B解析: 暂无解析 -
第13题:
原电池在某种情况下可能转变为电解池。
此题为判断题(对,错)。
正确答案:√
-
第14题:
下列有关原电池的叙述中,正确的是( )。A: 原电池是将化学能转化为电能的装置
B: 用导线连接的两种不同金属同时插入液体中.能形成原电池
C: 在原电池中,电子流出的一极是负极,发生氧化反应
D: 原电池放电时,电解质溶液中的阳离子向正极移动答案:A,C,D解析:将两种活泼性不同的金属用导线连接后插入电解质溶液中,形成闭合回路,
这样才能形成原电池。B项说法错误。故本题答案选ACD。 -
第15题:
有两个原电池,测得其电动势相等,这表明两原电池中反应的△G0值也相等。
正确答案:错误 -
第16题:
在300K、101.325kPa下,有一原电池的电动势E为2V,若在该温度、压力下,原电池向环境可逆输出了2F的电量,则此原电池对环境做了()的电功。
- A、385.94kJ
- B、-385.94kJ
- C、-4kJ
- D、-192.97kJ
正确答案:B -
第17题:
原电池电动势是原电池两极间的()。
- A、电位差
- B、最大电位差
- C、电流
- D、最大电流
正确答案:B -
第18题:
在原电池中增加氧化态物质的浓度,电池电动势增加。
正确答案:错误 -
第19题:
向原电池(-)Zn|Zn2+(1mol·L-1)||Cu2+(1mol·L-1)|Cu(+)的正极溶液中通入H2S气体,则原电池的电动势()
- A、增加
- B、减小
- C、不变
- D、无法判断
正确答案:B -
第20题:
向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第21题:
向原电池(-)Ag、的负极中加入NaCl,则原电池电动势变化是()。
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第22题:
单选题在300K、101.325kPa下,有一原电池的电动势E为2V,若在该温度、压力下,原电池向环境可逆输出了2F的电量,则此原电池对环境做了()的电功。A385.94kJ
B-385.94kJ
C-4kJ
D-192.97kJ
正确答案: D解析: 暂无解析 -
第23题:
单选题向原电池(-)Ag,AgCl|Cl-‖Ag+|Ag(+)的负极中加入NaCl,则原电池电动势的变化是( )。[2013年真题]A变大
B变小
C不变
D不能确定
正确答案: D解析:
原电池发生氧化还原反应,负极为:Ag-e-+Cl-=AgCl,正极为:Ag++e-=Ag。根据电极电势的能斯特方程式,有φ=φϴ+0.059lg[1/c(Cl-)]。由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,所以原电池的电动势E=φ正-φ负增大。
