门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:A.X单质不易与水反应 B.XO2可被碳或氢还原为XC.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
题目
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
相似考题
更多“门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:A.X单质不易与水反应 B.XO2可被碳或氢还原为XC.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高”相关问题
-
第1题:
图4为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )。
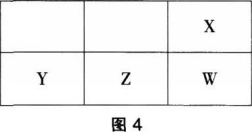 A.X、Z、W元素的原子半径依次递增
A.X、Z、W元素的原子半径依次递增
B.X元素常见氢化物的沸点高于W元素常见氢化物的沸点
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.Y、Z、W元素在自然界中均不能以游离态存在答案:B解析:因为X、Y、Z、W为短周期元素,X与W位于同主族,且W元素的核电荷数为X元素的2倍.则设X元素最外层电子数为x,则2+8+x=2(2+x),解得x=6,所以X为0,W为S,Z为P,Y为Si。P的原子半径大于S,A项错误。X元素常见氢化物为H2O,W元素常见氢化物为H2S,H2O含有氢键,故H2O的沸点高于H2S,B项正确。SiO2是原子晶体,其熔化需克服的是共价键,C项错误。S能以游离态存在于自然界中,D项错误。故本题选B。 -
第2题:
对元素周期律和元素周期表的发现有突出贡献的化学家是( )。A.门捷列夫
B.拉瓦锡
C.道尔顿
D.阿伏加德罗答案:A解析:【知识点】化学科学发展史
【解析】门捷列夫发现元素周期律,并编制了元素周期表;拉瓦锡首先通过实验验证了空气是由氮气和氧气组成的结论:道尔顿提出了近代原子学说:阿伏加德罗提出了分子与原子的区别。故本题选A。 -
第3题:
阅读下列材料,回答有关问题:
1829年,德国化学家德贝莱纳在研究元素的原子量和化学性质关系时.发现了几个性质相似的元素组,每组包括三种元素,如锂、钠、钾;钙、锶、钡。
1862年,法国地质学家尚古多把元素按其原子量大小顺序标在圆柱体表面的螺旋线上.他发现某些性质相近的元素都出现在一条线上.于是提出元素的性质随其原子量的变化具有周期性。
1868年,化学家迈尔研究了已知元素的原子量和物理性质的关系.把性质相近的元素划分为一族.并于l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫按原子量递增的顺序和元素化学性质的相似性把63种元素排列成几行,当按原子量排序与元素化学性质冲突时,他依据元素的化学性质调整位置.或留下空位。同年,他公布了他的第一张元素周期表。后来,他进行了更详细的族的划分.并于1871年公布了他第二张元素周期表。
之后,元素周期表被不断完善,成为化学研究的重要工具。直到20世纪初.物理学家们逐步揭开了原子结构的秘密,人们才清楚元素的性质呈现周期性变化的根本原因。
问题:
(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是什么?(2分)他们研究的主要区别是什么?(2分)
(2)元素周期律的发现对于化学科学的发展有什么重要意义?(4分)
(3)有人说“元素周期律的发现是物理与化学的完美结合”,结合材料谈谈你对这句话的理解。(2分)请回答元素性质呈现周期性变化的根本原因。(2分)答案:解析:(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是分类。迈尔研究的是元素的原子量和物理性质的关系.门捷列夫研究的是元素的原子量和化学性质的关系.他们研究的区别在于从不同的角度去认识元素、发现规律。
(2)元素周期律是自然科学的基本规律.元素周期表是元素周期律的具体表现形式.它反映了元素之间的内在联系。是对元素的一种很好的自然分类。我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导化学学习研究。元素周期律和元素周期表为新元素的发现及预测它们的原子结构和性质提供了线索。元素周期律和周期表对工农业生产也有一定的指导作用。由于在周期表中位置靠近的元素性质相近,这启发人们在周期表一定的区域内寻找新的物质.研究制造新品种农药、半导体材料、催化剂等。
(3)从1829年到1871年.人们没有停止对元素周期律的研究,但始终没有解决周期律变化的本质。直到20世纪初.物理学家们逐步揭开了原子结构的秘密.人们才清楚元素的性质呈现周期律变化的根本原因。所以说,元素周期律的发现是物理与化学的完美结合。
元素性质呈现周期性变化的根本原因是核外电子排布呈现周期性变化。 -
第4题:
门捷列夫于1871年的《化学元素的周期性依赖关系》发表了第二个化学元素周期表,明确指出:元素的性质和它们的化合物的性质与元素的原子量有周期性的依赖关系,元素的性质是元素原子量的( )。A.线性函数
B.非线性函数
C.周期函数
D.非周期函数答案:C解析:元素的性质是原子量的周期函数。 -
第5题:
1869年俄国化学家__________提出了元素周期律并编制了第一个周期表。1871年,他对周期表做出了重要修改,纠正了一些元素的原子量。答案:解析:门捷列夫 -
第6题:
1869年门捷列夫发现元素周期律时预言了一些当时尚未发现的元素的存在,“类铝”就是其中之一。1879年,门氏预言的“类铝”被发现,当时他己知:Ca与Ti的熔点分别为110、1941K,沸点分别为1757、3560K,密度分别为:1.55、4.50g/cm3,试预言在周期表中处于钙—钛之间的“类铝”熔沸点和密度,并与现代数据对比。
正确答案: “类铝”的熔点=(1110+1941)K/2=1526K
沸点=(1757+3560)K/2=2659K
密度=(1.55+4.50)g/cm3/2=3.03g/cm3
钪的熔点是1814K,沸点是3130K,密度是2.985g/cm3
两者比较,“类铝”和钪的熔沸点和密度相近。 -
第7题:
在元素周期表中,下面说法正确的是()。
- A、在元素周期表中,主族元素所表示的是由长周期元素和短周期元素共同组成的纵行
- B、同周期元素的性质相似
- C、元素按原子序数增大的顺序排列
- D、在表的末尾排列的元素组成的单质晶体都具有高沸点
正确答案:C -
第8题:
元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。 -
第9题:
()发现元素周期律,他认为,元素性质是原子量的周期函数,原子量决定元素的特征。
- A、爱因斯坦
- B、麦克斯韦
- C、门捷列夫
- D、牛顿
正确答案:C -
第10题:
发明元素周期表的是()。
- A、门捷列夫
- B、维勒
- C、爱迪生
- D、肖夫斯唐姆
正确答案:A -
第11题:
单选题元素周期律是哪位科学家发现的()A维勒
B门捷列夫
C李比希
D弗兰克兰
正确答案: C解析: 德米特里·伊万诺维奇·门捷列夫(1834年一1907年)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。 -
第12题:
判断题发现化学元素周期律的门捷列夫是俄罗斯科学家。A对
B错
正确答案: 错解析: 暂无解析 -
第13题:
阅读下列素材。回答有关问题:
1868年,化学家迈尔研究已知元素的原子量与其物理性质的关系时。把性质相近的元素划分为一个族.并与l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行。同年,他公布了他的第一张元素周期表,后来他汲取了迈尔周期表的优点,进行了更详细的族的划分】分,并于1871年公布了他的第二张元素周期表。
之后。元素周期表被不断完善。成为化学研究的重要工具,到20世纪初,物理学家们逐步
揭开了原子结构的秘密.人们才逐渐清楚了元素的性质呈周期性变化的原因。问题:
(1)迈尔和门捷列夫进行“族”划分时,运用的是什么科学方法?他们在研究元素原子量与性质的关系时不同之处是什么?
(2)元素周期律的发现对化学科学发展有什么重要意义?(3)举例说明元素周期律对化学知识学习的指导作用。答案:解析:(1)化学分类方法。
不同之处在于:迈尔研究的是元素的原子量与其物理性质的关系.门捷列夫研究的是元素
原子量与元素化学性质的关系。
迈尔研究元素原子量与其物理性质的关系时,把性质相近的元素划分为一个族:门捷列夫研究元素原子量与元素化学性质的关系时。把63种元素排列成几行,后来进行了更详细的族的划分。
(2)物理学家们逐步揭开了原子结构的秘密,逐渐清楚了元素的性质呈周期性变化的屑因。形成元素周期表。它是元素周期律的具体表现形式,反映了元素之间的内在联系。元素周其表是学习和研究化学的一种重要工具,我们可以利用元素的性质、它在周期表中的位置和原亏结构三者之间的密切关系来指导我们对化学的研究。
元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索。(3)例如.学习钠、镁、铝与水的反应时.学生可以进行以下实验.
得出结论:金属性强弱Na>Mg>A1
结合原子结构知识解释金属性强弱Na>Mg>A1
同周期元素,自左向右,最外层电子数逐渐增多,原子半径逐渐减小,金属性逐渐减弱。 -
第14题:
现代化学的元素周期律是l869年俄国科学家门捷列夫(DmitriMendeleev)首创的.他将当时已知的63种元素依相对原子质量大小并以表的形式排列.把有相似化学性质的元素放在同一列.制成元素周期表的雏形。经过多年修订后才成为当代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一横行称为一个周期.一列称为一个族。某学生总结元素周期表的四个特征:①除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数;②除短周期外,其他周期均为18种元素;③副族元素没有非金属元素;④碱金属元素是指IA族的所有的元素。其中正确的是( )。A.只有①③
B.只有②③
C.只有③
D.只有③④答案:C解析:因为F元素没有正价,所以①错;第六周期含有32种元素,②错;副族全部是金属元素,③正确;氢元素是非金属,位于IA族,④错。 -
第15题:
联合国将2019年定为“国际化学元素周期表年”,下列有关化学元素周期表的说法错误的是:A.元素周期表共有18列
B.元素周期表是俄国化学家门捷列夫编制的
C.今年是化学元素周期表创建150周年
D.元素周期表中元素是按原子从大到小排列的答案:D解析:第一步,本题考查化学知识并选错误项。
第二步,化学元素周期表中的化学元素是按照由小到大的顺序排列的,因此选项描述不正确。
因此,选择D选项。 -
第16题:
元素周期律是哪位科学家发现的( )
A.维勒
B.门捷列夫
C.李比希
D.弗兰克兰答案:B解析:德米特里·伊万诺维奇·门捷列夫(1834年一1907年)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。 -
第17题:
发现化学元素周期律的门捷列夫是俄罗斯科学家。
正确答案:正确 -
第18题:
1869年,化学家门捷列夫依据自己的判断,大胆提出元素周期律的科学家说,预言了()种当时尚未发现的元素及其特性
- A、1
- B、3
- C、9
- D、17
正确答案:B -
第19题:
超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素298114X,试根据原子结构理论和元素周期律预测: (1)114X元素位于元素周期表第()周期()族,为()元素(金属、非金属)。 (2)写出该元素最高价氧化物及其对应水化物的分子式()、(),并估计后者为()(酸、两性、碱) (3)该元素与氯生成化合物的分子式()、()。
正确答案:七;IVA;金属;XO2;X(OH)4;碱;XCl2;XCl4 -
第20题:
元素周期律是哪位科学家发现的()
- A、维勒
- B、门捷列夫
- C、李比希
- D、弗兰克兰
正确答案:B -
第21题:
对发现化学元素周期律作出了决定性贡献的是:()
- A、波义耳
- B、拉瓦锡
- C、门捷列夫
- D、维勒
正确答案:C -
第22题:
单选题发现元素周期律并编制出现在使用的元素周期表的科学家是()。A道尔顿
B阿伏加德罗
C门捷列夫
D拉瓦锡
正确答案: D解析: 道尔顿在化学上的主要贡献是提出了原子学说;阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说;门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表;拉瓦锡首先通过实验得出空气是由氮气和氧气组成的结论,因此本题选C。 -
第23题:
单选题人们对元素分类可以追溯到我国古代的“五行”说,1869年3月,()明确提出了“元素周期律”,并制成了“元素周期表”。A俄国人门捷列夫
B德国人迈尔
C德国人德贝莱纳
D德国人纽兰慈
正确答案: C解析:
