在酸碱滴定中,以0.1000mol·L-1NaOH标准溶液滴定20.00mL 0.1000mol·L-1HCl溶液时,滴定曲线的pH突跃范围是( )。 A 9.70~4.30 B 4.30~9.70 C 7.70~9.70 D 9.70~7.70
题目
A 9.70~4.30
B 4.30~9.70
C 7.70~9.70
D 9.70~7.70
相似考题
更多“在酸碱滴定中,以0.1000mol·L-1NaOH标准溶液滴定20.00mL 0.1000mol·L-1HCl溶液时,滴定曲线的pH突跃范围是( )。 ”相关问题
-
第1题:
用0.1000mol/LNaOH滴定0.1000mol/LHAc(pKa=4.7)时的pH突跃范围为7.7~9.7,由此可以推断用0.1000mol/LNaOH滴定pKa为3.7的0.1mol/L某一元酸的pH突跃范围为()。A、6.7~8.7
B、6.7~9.7
C、8.7~10.7
D、7.7~10.7
参考答案:B
-
第2题:
酸碱滴定曲线是以变化为特征的滴定()时酸、碱浓度越()滴定的突跃范围越()酸碱的强度越(),则滴定的突跃范围越()。参考答案:溶液的PH值,浓,长,大,大
-
第3题:
用NaOH滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L)时,其滴定突跃的pH范围为( )
A.7.74~9.70
B.5.3~8.7
C.4.3~9.7
D.3.3~10.7
E.6.24~4.30
正确答案:C
-
第4题:
用CHCl=0.1000mol/L的标准溶液滴定如下弱碱:
得到四条滴定曲线,其中滴定突跃最小的是( )。A. ①
B. ②
C. ③
D. ④答案:D解析:本题中,用CHCl=0.1000mol/L的标准溶液滴定相应的弱碱,Kb越小,则滴定突跃范围越小。 -
第5题:
用下列四种不同浓度的NaOH标准溶液:①1.000mol/L;②0.5000mol/L;③0.1000mol/L;④0.01000mol/L。滴定相应浓度的HCl标准溶液,得到滴定曲线,其中滴定突跃最宽,可供选择的指示剂最多的是( )。A. ①
B. ②
C. ③
D. ④答案:A解析:在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱滴定中的pH)的突然改变就是滴定突跃,突跃所在的范围称为突跃范围。突跃的大小受滴定剂浓度(c)和酸(或碱)的解离常数影响,c越大,解离常数越大,突跃越大。 -
第6题:
在强酸滴定强碱溶液时,当酸碱浓度增大10倍,滴定pH值突跃范围就增加()个单位。
正确答案:2 -
第7题:
用0.1000mol·L-1NaOH测定铵盐中含氮量,选择的滴定方式是()
- A、直接滴定
- B、间接滴定
- C、返滴定
- D、络合滴定
正确答案:B -
第8题:
在酸碱滴定中,选择强酸强碱作为滴定剂的理由是()
- A、强酸强碱可以直接配制标准溶液
- B、使滴定突跃尽量大
- C、加快滴定反应速率
- D、使滴定曲线较完美
正确答案:B -
第9题:
以0.1000mol/L的NaOH溶液滴定20.00mL浓度为0.1000mol/L的HCl溶液,加入20.02mL的NaOH后,溶液的pH值是()。
- A、9.70
- B、4.30
- C、2.28
- D、11.72
正确答案:A -
第10题:
酸碱滴定曲线是以()变化为特征的。滴定时酸、碱的浓度越大,滴定突跃范围越()。酸碱的强度越大,则滴定的突跃范围越()。
正确答案:pH值;大;大 -
第11题:
判断题用浓度均为0.1000mol·L-1HCl标准溶液滴定NaOH溶液,可选择酚酞做指示剂。A对
B错
正确答案: 对解析: 暂无解析 -
第12题:
单选题在酸碱滴定中,选择强酸强碱作为滴定剂的理由是()A强酸强碱可以直接配制标准溶液
B使滴定突跃尽量大
C加快滴定反应速率
D使滴定曲线较完美
正确答案: C解析: 暂无解析 -
第13题:
用0.2000 mol·L-1HCl滴定20.00mL 0.1000mol·L-1NaOH溶液,当达到化学计量点时,溶液的pH值是:( )A.pH>7.0
B.pH=7.0
C.pH<7.0
D.无法确定
参考答案:B
-
第14题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH是( )
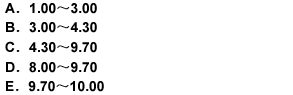 正确答案:C
正确答案:C
-
第15题:
用CHCl=0.1000mol/L的标准溶液滴定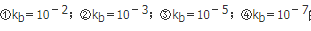
的弱碱溶液,得到四条滴定曲线,其中滴定突跃最长的是( )。A. ①
B. ②
C. ③
D. ④答案:A解析:在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱滴定中的pH)的突然改变即滴定突跃,突跃所在的范围称为突跃范围。若等浓度的强酸强碱相互滴定,滴定时其起始浓度减少一个数量级,则滴定突跃缩小两个pH单位。因此可知滴定突跃最长的应该是标准溶液初始浓度最大的。 -
第16题:
用下列四种不同浓度的NaOH标准溶液①1.000mol/L;②0.5000mol/L;③0.1000mol/L;④0.01000mol/L滴定相应浓度的HCl标准溶液,得到四条滴定曲线,其中滴定突跃最宽,可供选择的指示剂最多的是( )。A.①
B.②
C.⑧
D.④答案:A解析:分析化学中,在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱滴定中pH)的突然改变就是滴定突跃,突跃所在的范围称为突跃范围。突跃的大小受滴定剂浓度(c)和酸(或碱)的解离常数影响,c越大,突跃越大,解离常数越大,突跃越大。 -
第17题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH值是
A. 1.00 ~3.00 B. 3.00~4. 30
C. 4.30 ~9.70 D. 8.00~9.70
E. 9. 70 ~10. 00答案:C解析:C
解答:药物分析中的计算试题每年在考试中都有出现,但难度都不大,考生应熟记公式及运算步骤,不要在这些试题上丢分。在计量点附近的突变的pH值范围为滴定突跃。滴定突跃范围的大小与溶液的浓度有关,不难看出,浓度增大10倍,突跃范围前后增加1个pH单位。由于1mol/l的NaOH滴定1mol/L的HC1,突跃范围为3.3~10.7,所以0.1000mol/l的MaOH滴定0.1000mol/L的HC1,突跃范围为4.3~9.7。答案为C。 -
第18题:
用HCl滴定液(0.1000mol/L)滴定25.00mLNaOH溶液,终点时消耗HCl滴定液20.00ml,则NaOH溶液的浓度为()
- A、0.1000mol/L
- B、0.1250mol/L
- C、0.08000mol/L
- D、0.8000mol/L
正确答案:B -
第19题:
用浓度均为0.1000mol·L-1HCl标准溶液滴定NaOH溶液,可选择酚酞做指示剂。
正确答案:正确 -
第20题:
在酸碱滴定中,以0.1000mol·L-1NaOH标准溶液滴定20.00mL0.1000mol·L-1HCl溶液时,滴定曲线的pH突跃范围是()。
- A、9.70~4.30
- B、4.30~9.70
- C、7.70~9.70
- D、9.70~7.70
正确答案:C -
第21题:
以0.1000mol/LHCl溶液滴定20.00mL0.1000mol/LNH3(Kb=1.8x10-5)溶液,计算滴定前,滴定突跃范围(滴定误差在0.1%范围)及化学计量点的pH值。
正确答案: 滴定前0.1000mol/LNH3溶液,c/Kb>100,cKb>10Kw
可用最简式[OH-]=(cKb)1/2=1.30x10-5mol/L,pOH=2.89pH=11.11
滴定误差-0.1%,加入HCl19.98mL时
因为HCl的滴入,溶液为NH3及其共轭酸NH4+组成的缓冲溶液,
pH=pKb+lg[Ac-]/[HAc]=4.74+lg(0.02/19.98)=6.30
滴定误差+0.1%,加入NaOH20.02mL时,HCl过量,
[H+]=(20.02-20.00)/(20.02+20.00)=5.00x10-5mol/L,pOH=4.30,pH=4.30
滴定突跃范围:6.30~4.30
化学计量点,HCl和NH3定量反应全部生成NH4Cl,又因溶液的体积增大1倍,
故:CNH4+=0.0500mol/L,此时溶液的酸度主要由NH4+的解离所决定。
Ka=Kw/Kb=5.6x10-10,c/Ka>100,cKa>10Kw,
所以[H+]=(cKa)1/2=(0.0500x5.6x10-10)1/2=5.3x10-6mol/L,pH=5.28 -
第22题:
单选题在酸碱滴定中,以0.1000mol·L-1NaOH标准溶液滴定20.00mL0.1000mol·L-1HCl溶液时,滴定曲线的pH突跃范围是()。A9.70~4.30
B4.30~9.70
C7.70~9.70
D9.70~7.70
正确答案: D解析: 从滴定开始到滴定分数为99.9%,滴定液的pH值的变化幅度缓慢增大,总共加入了NaOH溶液19.98mL,滴定液的pH值由1.0增大到4.3,pH值只增大了3.3。从滴定分数为99.9%到100.1%,即与计量点滴定分数100.0%的误差仅±0.1%,只加入NaOH溶液0.04mL(约为1滴),滴定液的pH值却由4.3猛增到9.7,pH值增大了5.4,溶液由酸性突变为碱性,发生了质的飞跃。滴定分数超过100.1%以后,滴定液pH值的变化幅度又渐趋缩小。在计量点前后滴定曲线的变化并不完全对称,这是滴定液体积逐渐增大所致。 -
第23题:
单选题以0.1000mol/L的NaOH溶液滴定20.00mL浓度为0.1000mol/L的HCl溶液,加入20.02mL的NaOH后,溶液的pH值是()。A9.70
B4.30
C2.28
D11.72
正确答案: B解析: 暂无解析
