阅读下列素材,回答有关问题1868年,化学家迈尔研究已知元素的原子量与其物理性质的关系时,把性质相近的元素划分为一个族,并与1869年制作了他的第一张元素周期表。1869年,化学家门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行,同年,他公布了他的第一张元素周期表,后来他汲取了迈尔周期表的优点,进行了更详细的族的划分,并于1871年公布了他的第三张元素周期表。之后,元素周期表被不断完善,成为化学研究的重要工具,到20世纪初,物理学家们逐步揭开了原子结构的秘密,人们才逐渐清楚了元素的性质
题目
阅读下列素材,回答有关问题1868年,化学家迈尔研究已知元素的原子量与其物理性质的关系时,把性质相近的元素划分为一个族,并与1869年制作了他的第一张元素周期表。1869年,化学家门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行,同年,他公布了他的第一张元素周期表,后来他汲取了迈尔周期表的优点,进行了更详细的族的划分,并于1871年公布了他的第三张元素周期表。之后,元素周期表被不断完善,成为化学研究的重要工具,到20世纪初,物理学家们逐步揭开了原子结构的秘密,人们才逐渐清楚了元素的性质呈周期性变化的原因。问题(1)迈尔和门捷列夫进行“族”划分时,运用的是什么科学方法?他们在研究元素原子量与性质的关系时不同之处是什么?(2)元素周期律的发现对化学科学发展有什么重要意义?(3)举例说明元素周期律对化学知识学习的指导作用。
相似考题
参考答案和解析
答案:
解析:
(1)化学分类方法。不同之外在于:迈尔研究的是原子量与物理性质的关系,门捷列夫研究的是原子量与元素化学性质的关系。迈尔研究原子量与其物理性质的关系时,把性质相近的元素划分为一个族;门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行,后来进行了更详细的族的划分。(2)物理学家们逐步揭开了原子结构的秘密,逐渐清楚了元素的性质呈周期性变化的原因,形成元素周期表,是元素周期律的具体表现形式,它反映了元素之间的内在联系。元素周期表是学习和研究化学的一种重要工具,我们可以利用元素的性质、它在周期表中的位置和原子结构三者之间的密切关系来指导我们对化学的学习研究。元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索。(3)例如:学习钠、镁、铝与水的反应时,学生可以通过以下实验:
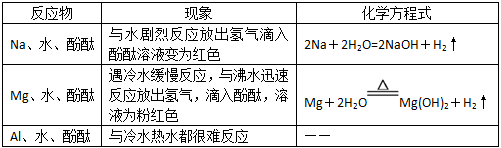
得出结论:金属性强弱Na>Mg>Al结合原子结构知识解释金属性强弱Na>Mg>Al同周期元素,自左向右,最外层电子越来越多,原子半径越来越小,金属性越来越弱。

得出结论:金属性强弱Na>Mg>Al结合原子结构知识解释金属性强弱Na>Mg>Al同周期元素,自左向右,最外层电子越来越多,原子半径越来越小,金属性越来越弱。
更多“阅读下列素材,回答有关问题1868年,化学家迈尔研究已知元素的原子量与其物理性质的关系时,把性质相近的元素划分为一个族,并与1869年制作了他的第一张元素周期表。1869年,化学家门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行,同年,他公布了他的第一张元素周期表,后来他汲取了迈尔周期表的优点,进行了更详细的族的划分,并于1871年公布了他的第三张元素周期表。之后,元素周期表”相关问题
-
第1题:
现代化学的元素周期律是l869年俄国科学家门捷列夫(DmitriMendeleev)首创的.他将当时已知的63种元素依相对原子质量大小并以表的形式排列.把有相似化学性质的元素放在同一列.制成元素周期表的雏形。经过多年修订后才成为当代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一横行称为一个周期.一列称为一个族。某学生总结元素周期表的四个特征:①除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数;②除短周期外,其他周期均为18种元素;③副族元素没有非金属元素;④碱金属元素是指IA族的所有的元素。其中正确的是( )。A.只有①③
B.只有②③
C.只有③
D.只有③④答案:C解析:因为F元素没有正价,所以①错;第六周期含有32种元素,②错;副族全部是金属元素,③正确;氢元素是非金属,位于IA族,④错。 -
第2题:
高中化学《元素周期表》
一、考题回顾
题目来源1月6日上午 吉林省白城市面试考题
试讲题目1.题目:元素周期表
2.内容:
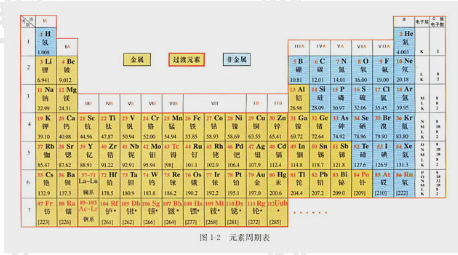
在周期表中,把电子层数相同的元素,按原子序数递增的顺序从左至右排成横行,再把不同横行中最外层电子数相同的元素,按照电子层递增的顺序由上而下排成纵行。
元素周期表有7个横行,叫做周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
在周期表中有些族的元素还有一些特别的名称。例如:
第ⅠA族(除氢):碱金属元素
第ⅦA族:卤族元素
0族:稀有气体元素
3.基本要求:
(1)讲解直观,通俗易懂。
(2)重点讲解元素周期表的特点。
(3)板书工整有条理。
(4)要有提问环节
答辩题目1.简要概述元素周期表中元素的金属性和非金属性变化的规律
2.本节课的教学重难点是什么?
二、考题解析
【教学过程】
(一)故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
(二)新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
【教师提问】从周期表中,大家还可以发现哪些信息?
【学生回答】还可以看出每种原子的元素符号,相对原子质量。
【引导观察】周期表中哪些族有特殊的名称。
【学生回答】第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素
(三)拓展提高
【学生活动】画出前4周期的图,并填上原子。
(四)小结作业
小结:引导学生共同总结本节课的内容。
作业:思考同一周期或者同一主族的元素的化学性质有什么规律。
【板书设计】

1.简要概述元素周期表中元素的金属性和非金属性变化的规律。
2.本节课的教学重难点是什么?答案:解析:1.
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
2.
周期表的知识是对前面学习的知识的整合,是后续学习元素周期律的基础,因此本节课的教学重点是认识周期、主族和副族。
周期表所包含的信息较多,虽然学生在初中有简单的了解过,但是其所包含的信息相对较为抽象,需要一定的基础能力,学生比较难掌握全部,因此本节课的教学难点是能够用元素周期表中的位置来表示元素。 -
第3题:
高中化学《元素周期表》
二、考题解析
【教学过程】
环节一:故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
环节二:新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
 答案:解析:
答案:解析:

-
第4题:
1869年俄国化学家__________提出了元素周期律并编制了第一个周期表。1871年,他对周期表做出了重要修改,纠正了一些元素的原子量。答案:解析:门捷列夫 -
第5题:
元素周期表将全部元素分为多少族?
正确答案: 18 -
第6题:
1869年,已知的化学元素达63种,而且这期间的研究表明,元素的原子量和化学性质之间有着一定的关系。原子---分子论确立以后,化学上又一个重大的突破是()
- A、元素周期表的发现
- B、地球周期表的发现
- C、潮汐周期表的发现
- D、月亮周期变化的发现
正确答案:A -
第7题:
周期表的排列是依照元素的原子量排列的。
正确答案:错误 -
第8题:
元素周期表第一族的化学元素锂、钠、钾、铷、铯通称为()元素。
正确答案:碱金属 -
第9题:
元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。 -
第10题:
填空题元素周期表第一族的化学元素锂、钠、钾、铷、铯通称为()元素。正确答案: 碱金属解析: 暂无解析 -
第11题:
单选题周期表的排列是依照元素的()排列的。A原子量
B化学性质
C属性
正确答案: A解析: 暂无解析 -
第12题:
问答题元素周期表将全部元素分为多少族?正确答案: 18解析: 暂无解析 -
第13题:
阅读下列材料,回答有关问题:
1829年,德国化学家德贝莱纳在研究元素的原子量和化学性质关系时.发现了几个性质相似的元素组,每组包括三种元素,如锂、钠、钾;钙、锶、钡。
1862年,法国地质学家尚古多把元素按其原子量大小顺序标在圆柱体表面的螺旋线上.他发现某些性质相近的元素都出现在一条线上.于是提出元素的性质随其原子量的变化具有周期性。
1868年,化学家迈尔研究了已知元素的原子量和物理性质的关系.把性质相近的元素划分为一族.并于l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫按原子量递增的顺序和元素化学性质的相似性把63种元素排列成几行,当按原子量排序与元素化学性质冲突时,他依据元素的化学性质调整位置.或留下空位。同年,他公布了他的第一张元素周期表。后来,他进行了更详细的族的划分.并于1871年公布了他第二张元素周期表。
之后,元素周期表被不断完善,成为化学研究的重要工具。直到20世纪初.物理学家们逐步揭开了原子结构的秘密,人们才清楚元素的性质呈现周期性变化的根本原因。
问题:
(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是什么?(2分)他们研究的主要区别是什么?(2分)
(2)元素周期律的发现对于化学科学的发展有什么重要意义?(4分)
(3)有人说“元素周期律的发现是物理与化学的完美结合”,结合材料谈谈你对这句话的理解。(2分)请回答元素性质呈现周期性变化的根本原因。(2分)答案:解析:(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是分类。迈尔研究的是元素的原子量和物理性质的关系.门捷列夫研究的是元素的原子量和化学性质的关系.他们研究的区别在于从不同的角度去认识元素、发现规律。
(2)元素周期律是自然科学的基本规律.元素周期表是元素周期律的具体表现形式.它反映了元素之间的内在联系。是对元素的一种很好的自然分类。我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导化学学习研究。元素周期律和元素周期表为新元素的发现及预测它们的原子结构和性质提供了线索。元素周期律和周期表对工农业生产也有一定的指导作用。由于在周期表中位置靠近的元素性质相近,这启发人们在周期表一定的区域内寻找新的物质.研究制造新品种农药、半导体材料、催化剂等。
(3)从1829年到1871年.人们没有停止对元素周期律的研究,但始终没有解决周期律变化的本质。直到20世纪初.物理学家们逐步揭开了原子结构的秘密.人们才清楚元素的性质呈现周期律变化的根本原因。所以说,元素周期律的发现是物理与化学的完美结合。
元素性质呈现周期性变化的根本原因是核外电子排布呈现周期性变化。 -
第14题:
一、考题回顾
题目:高中化学《元素周期表》
内容: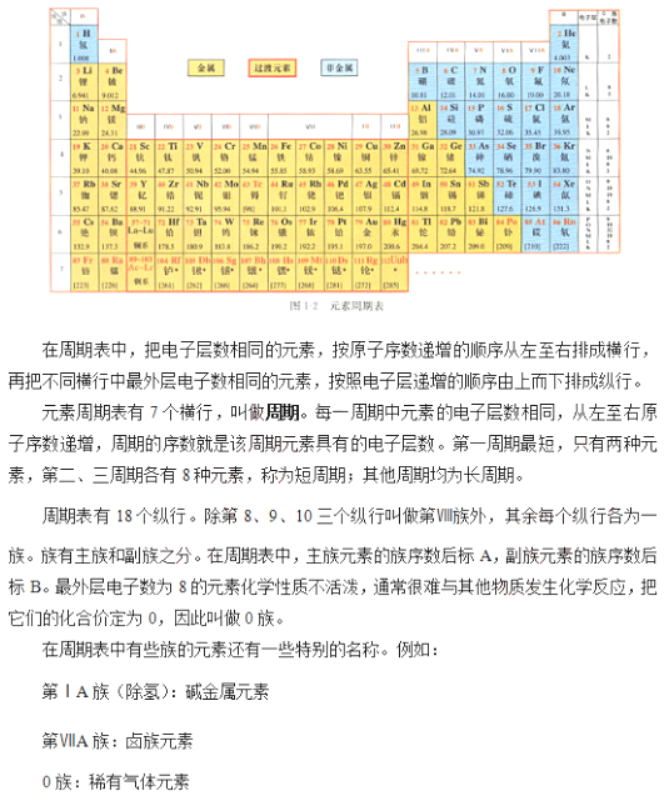

二、考题解析
【教学过程】
环节一:故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
环节二:新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
【教师提问】从周期表中,大家还可以发现哪些信息?
【学生回答】还可以看出每种原子的元素符号,相对原子质量。
【引导观察】周期表中哪些族有特殊的名称。
【学生回答】第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素
环节三:拓展提高
【学生活动】画出前4周期的图,并填上原子。
环节四:小结作业
小结:引导学生共同总结本节课的内容。
作业:思考同一周期或者同一主族的元素的化学性质有什么规律。
【答辩题目】
1.简要概述元素周期表中元素的金属性和非金属性变化的规律。
2.本节课学习的作用和意义是什么?答案:解析: -
第15题:
门捷列夫于1871年的《化学元素的周期性依赖关系》发表了第二个化学元素周期表,明确指出:元素的性质和它们的化合物的性质与元素的原子量有周期性的依赖关系,元素的性质是元素原子量的( )。A.线性函数
B.非线性函数
C.周期函数
D.非周期函数答案:C解析:元素的性质是原子量的周期函数。 -
第16题:
周期表的排列是依照元素的()排列的。
- A、原子量
- B、化学性质
- C、属性
正确答案:A -
第17题:
参加生物体组成的元素,总数(),在元素周期表中分布在元素周期表的(),即属于相对原子量较轻的一批元素。
正确答案:30多种;上部和中间部分 -
第18题:
在元素周期表中,同一族元素得到电子的能力自上而下减弱。
正确答案:正确 -
第19题:
通过元素周期表,可以知道元素的()。
- A、符号
- B、原子量
- C、电子数
- D、核外电子排布
正确答案:A,B,C -
第20题:
元素周期表中,周期是依()划分的,族是依()划分的。主族元素与副族元素在原子结构上的区别在于()。
正确答案:能级组;外电子层结构;最后一个电子填充的能级 -
第21题:
问答题阅读下面文字,回答相关问题。 元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。 请回答下列问题: (1)有人说"氦的最外层电子数为2,应该把它放在第ⅡA族",你认为这样编排元素周期表有何利弊? (2)结合化学教学实践,论述三序结合的原则在化学教材编写中"原子结构和元素周期表"理论部分的应用。正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。
(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知过程和心理发展过程及知识体系:理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。解析: 暂无解析 -
第22题:
问答题元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。解析: 暂无解析 -
第23题:
填空题参加生物体组成的元素,总数(),在元素周期表中分布在元素周期表的(),即属于相对原子量较轻的一批元素。正确答案: 30多种,上部和中间部分解析: 暂无解析
