请教:2009年自治州恩施州初中毕业生学业考试化学试题第2大题第2小题如何解答?【题目描述】第 2 题元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;⑵ 元素的化学性质与原子结构中的______________数关系密切;⑶ 在同一族中
题目
【题目描述】
第 2 题元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排
布,我们对它进行研究:

⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
⑵ 元素的化学性质与原子结构中的______________数关系密切;
⑶ 在同一族中,各元素的原子结构呈现的规律有________________ (任写一点);
⑷ 研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
相似考题
参考答案和解析
参考答案分析】:
⑴ 非金属 ;得 ;
⑵ 最外层电子 ;
⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷ 逐渐减小
更多“请教:2009年自治州恩施州初中毕业生学业考试化学试题第2大题第2小题如何解答? 【题目描述】 第 2 题元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排 布,我们对它进行研究: ⑴ 第16号元素属于_______元素(填金属或非金属),它在化学反应中容易________(填得或失)电子; ⑵ 元素的化学性质与原子结构中的______________数关系密切; ⑶ 在同一族中,各元素的原子结构呈现的规律有_________”相关问题
-
第1题:
A、B、C为短周期元素,它们在元素周期表中的位置关系如图1-8所示.已知B、C两元素原子序数之和是A元素原子序数的4倍.则A元素的符号为____________,C元素的原子结构示意图为____________.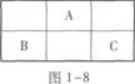 答案:解析:【解题指要】 根据A、B、C在元素周期表中的位置(如图1-16所示)可知,A位于第二周期,B、C位于第三周期.所以,若设A元素的原子序数为x,则B、C两元素的原子序数分别为(x+7)和(x+9).
答案:解析:【解题指要】 根据A、B、C在元素周期表中的位置(如图1-16所示)可知,A位于第二周期,B、C位于第三周期.所以,若设A元素的原子序数为x,则B、C两元素的原子序数分别为(x+7)和(x+9).
根据题意得:(x+7)+(x+9)=4x,即x=8.
由此可知A是8号元素氧,其元素符号是O,B是15号元素磷,C
-
第2题:
已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符号:(1) 第四周期第ⅣB族__________;(2) 第五周期第ⅥA族__________。答案:解析:(1) Ti: 3d 24s2 (2)Te: 5s25p4 -
第3题:
稀土金属属于()元素
- A、第ⅢA族元素
- B、第ⅡA族元素
- C、第ⅢB族元素
- D、第ⅡB族元素
正确答案:C -
第4题:
阅读下面文字,回答相关问题。 元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。 请回答下列问题: (1)有人说"氦的最外层电子数为2,应该把它放在第ⅡA族",你认为这样编排元素周期表有何利弊? (2)结合化学教学实践,论述三序结合的原则在化学教材编写中"原子结构和元素周期表"理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。
(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知过程和心理发展过程及知识体系:理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。 -
第5题:
元素周期表与原子结构关系()。
- A、原子序数=核电荷数
- B、周期序数=电子层数
- C、主族序数=最外层电子数
- D、族元素最外层电子数为8
正确答案:A,B,C -
第6题:
原子序数是10的元素在元素周期表中属第几周期?第几族?是金属元素还是非金属元素?
正确答案:第二周期;第O族;非金属元素。 -
第7题:
超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素298114X,试根据原子结构理论和元素周期律预测: (1)114X元素位于元素周期表第()周期()族,为()元素(金属、非金属)。 (2)写出该元素最高价氧化物及其对应水化物的分子式()、(),并估计后者为()(酸、两性、碱) (3)该元素与氯生成化合物的分子式()、()。
正确答案:七;IVA;金属;XO2;X(OH)4;碱;XCl2;XCl4 -
第8题:
元素周期表中,周期是依()划分的,族是依()划分的。主族元素与副族元素在原子结构上的区别在于()。
正确答案:能级组;外电子层结构;最后一个电子填充的能级 -
第9题:
某元素其原子最外层有2个电子,次外层有13个电子,问此元素在周期表中应属哪族?最高正价是多少?是金属还是非金属?
正确答案:应该属于ⅦB簇,最高正价+7,金属。 -
第10题:
问答题原子序数是10的元素在元素周期表中属第几周期?第几族?是金属元素还是非金属元素?正确答案: 第二周期;第O族;非金属元素。解析: 暂无解析 -
第11题:
填空题超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素298114X,试根据原子结构理论和元素周期律预测: (1)114X元素位于元素周期表第()周期()族,为()元素(金属、非金属)。 (2)写出该元素最高价氧化物及其对应水化物的分子式()、(),并估计后者为()(酸、两性、碱) (3)该元素与氯生成化合物的分子式()、()。正确答案: 七,IVA,金属,XO2,X(OH)4,碱,XCl2,XCl4解析: (1)每周期中含有的元素种类分别是2、8、8、18、18、32、32,即第七周期如果全部排满,则最后一种元素的原子序数是118,所以114号元素位于第七周期ⅣA族。铅是金属,所以该元素也是金属。
(2)第ⅣA族也是的最高价是+4价,所以该元素最高价氧化物及其对应水化物的分子式分别是XO2、X(OH)4。同主族自上而下金属性逐渐增强,最高价氧化物的水化物的碱性逐渐增强,所以其氢氧化物是碱。
(3)第ⅣA族也是的主要化合价是+2价和+4价,因此该元素与氯生成化合物的分子式可以是XCl2、XCl4。 -
第12题:
问答题原子序数是17的元素,在周期表中属第几周期?第几族?说明属于金属元素还是非金属元素?正确答案: 第三周期,第七主族,属非金属元素。解析: 暂无解析 -
第13题:
已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符号:
(1)第四周期第Ⅳ 族_______;
族_______;
(2)第五周期第Ⅵ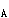 族_______。答案:解析:Ti:3d
族_______。答案:解析:Ti:3d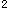 4s
4s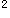 Te:5s
Te:5s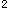 5p
5p
-
第14题:
高中化学《元素周期表》
一、考题回顾
题目来源1月6日上午 吉林省白城市面试考题
试讲题目1.题目:元素周期表
2.内容:
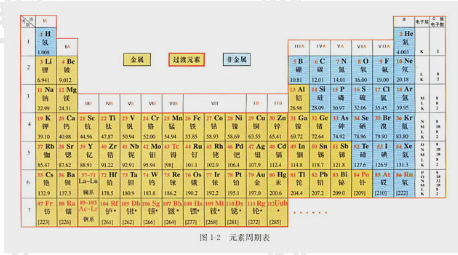
在周期表中,把电子层数相同的元素,按原子序数递增的顺序从左至右排成横行,再把不同横行中最外层电子数相同的元素,按照电子层递增的顺序由上而下排成纵行。
元素周期表有7个横行,叫做周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
在周期表中有些族的元素还有一些特别的名称。例如:
第ⅠA族(除氢):碱金属元素
第ⅦA族:卤族元素
0族:稀有气体元素
3.基本要求:
(1)讲解直观,通俗易懂。
(2)重点讲解元素周期表的特点。
(3)板书工整有条理。
(4)要有提问环节
答辩题目1.简要概述元素周期表中元素的金属性和非金属性变化的规律
2.本节课的教学重难点是什么?
二、考题解析
【教学过程】
(一)故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
(二)新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
【教师提问】从周期表中,大家还可以发现哪些信息?
【学生回答】还可以看出每种原子的元素符号,相对原子质量。
【引导观察】周期表中哪些族有特殊的名称。
【学生回答】第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素
(三)拓展提高
【学生活动】画出前4周期的图,并填上原子。
(四)小结作业
小结:引导学生共同总结本节课的内容。
作业:思考同一周期或者同一主族的元素的化学性质有什么规律。
【板书设计】

1.简要概述元素周期表中元素的金属性和非金属性变化的规律。
2.本节课的教学重难点是什么?答案:解析:1.
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
2.
周期表的知识是对前面学习的知识的整合,是后续学习元素周期律的基础,因此本节课的教学重点是认识周期、主族和副族。
周期表所包含的信息较多,虽然学生在初中有简单的了解过,但是其所包含的信息相对较为抽象,需要一定的基础能力,学生比较难掌握全部,因此本节课的教学难点是能够用元素周期表中的位置来表示元素。 -
第15题:
某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答: 该元素的原子序数,符号,所处周期和族。
正确答案: 原子系数为27,元素符号为Co,第4周期,第Ⅷ族 -
第16题:
已知某元素+2价离子的核外电子排布式为:[Ar]3d5,该元素在周期表中处于()周期、()族、()区,元素符号是()。
正确答案:第四;ⅦB;d;Mn -
第17题:
原子序数是17的元素,在周期表中属第几周期?第几族?说明属于金属元素还是非金属元素?
正确答案:第三周期,第七主族,属非金属元素。 -
第18题:
超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素114298X,试根据原子结构理论和元素周期律预测正确的是()
- A、114298X位于第七周期,第ⅣA族
- B、X是非金属元素
- C、XO2是酸性氧化物
- D、X元素的化合价有+2和+4
正确答案:A,D -
第19题:
某元素原子主量子数n为4的电子层上有7个电子,该元素原子外层电子构型是(),未成对电子数为(),原子核外电子分布式为(),该元素原子序数是(),它位于第()周期,第()族,最高氧化数()。
正确答案:4s24p5;1;1s22s22p63s23p63d104s24p5;35;四;ⅦA;+7 -
第20题:
元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。 -
第21题:
已知某元素为第四周期元素,其二价离子的外层有18个电子,则该元素的原子序数为(),元素符号为(),在周期表中的()区,第()族。
正确答案:20;Ca;S;ⅡA -
第22题:
问答题元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。解析: 暂无解析 -
第23题:
单选题某元素正二价离子(M2+)的电子构型是3s23p6,该元素在元素周期表中的位置是( )。[2018年真题]A第三周期,第Ⅷ族
B第三周期,第ⅥA族
C第四周期,第ⅡA族
D第四周期,第Ⅷ族
正确答案: A解析:
该元素完整的核外电子排布为1s22s22p63s23p64s2,周期数为最高主量子数,族竖数为价电子数。由此可知,n=4,即为第四周期;价电子为2,即为第ⅡA族。
