称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL。移取25.00mL,加入H2SO4及KI,以Na2S2O3溶液滴定至终点,消耗25.00mL。计算此Na2S2O3溶液的物质的量浓度。 [Mr(K2Cr2O7)=294.2]
题目
称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL。移取25.00mL,加入H2SO4及KI,以Na2S2O3溶液滴定至终点,消耗25.00mL。计算此Na2S2O3溶液的物质的量浓度。 [Mr(K2Cr2O7)=294.2]
相似考题
更多“称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL。移取25.00mL,加入H2SO4及KI,以Na2S2O3溶液滴定至终点,消耗25.00mL。计算此Na2S2O3溶液的物质的量浓度。 [Mr(K2Cr2O7)=294.2]”相关问题
-
第1题:
称取分析纯试剂K2Cr2O7,14.7090g,在容量瓶中配成500.00mL溶液,计算:(1)K2Cr2O7溶液的物质的量浓度;(2)K2Cr2O7溶液对Fe2O3和Fe3O4的滴定度。
答案: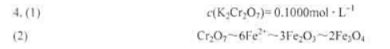
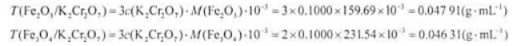
-
第2题:
称取纯Na2C2O4的质量为0.1816g,在酸性溶液中用KMnO4滴定,需消耗26.02ml。双氧水1.00ml在250ml容量瓶中稀释至刻度,吸取25.00ml,酸化后用上述KMnO4溶液滴定,到达终点时需消耗13.52mlKMnO4,求:KMnO4溶液的摩尔浓度C,试样中H2O2的含量。
正确答案:
-
第3题:
以K2Cr2O7标定Na2S2O3标准溶液时,滴定前加水稀释时是为了()。
- A、便于滴定操作
- B、保持溶液的弱酸性
- C、防止淀粉凝聚
- D、防止碘挥发
正确答案:B -
第4题:
称取大理石(CaCO3)试样0.2500g,用HCL溶解,加入PH=10的缓冲溶液和少许K--B指示剂,用CEDAT=0.1000mol/L的EDTA溶液滴定至终点时,消耗25.00ml,计算试样中CaO的质量分数是多少?
正确答案: 解:CaO%=(C×V×CaO×100)/(G×1000)
=(0.1000×25.00×56.08×100)/(0.2500×1000)=56.08(%)
答:试样中CaO的质量分数是56.08%。 -
第5题:
以K2Cr2O7标准溶液标定Na2S2O3溶液浓度时,采用了何种滴定方式?能否采用K2Cr2O7标准溶液直接滴定Na2S2O3溶液,为什么?
正确答案:KMnO4 与C2O42-的反应速度很慢,但Mn(II)可催化该反应。KMnO4 与C2O42-反应开始时,没有或极少量,故反应速度很慢,KMnO4的红色消失得很慢。随着反应的进行,Mn(II)不断产生,反应将越来越快,所以KMnO4的红色消失速度由慢到快,此现象即为自动催化反应。 -
第6题:
称取有机试样1.5867g置于碘量瓶中,用10mL四氯化碳溶解,取15.00mL氯化碘溶液于同一碘量瓶中,放在暗处1h后再加15%的KI溶液20mL及100mL水后,用0.1015mol/L的Na2S2O3标准滴定溶液滴定至终点,消耗Na2S2O3标准滴定溶液7.82mL。在同样条件下作空白试验,消耗Na2S2O3标准滴定溶液35.43mL。该样品的碘值为()。【己知碘的原子量为126.9】
- A、22.28g
- B、22.35g
- C、22.38g
- D、22.41g
正确答案:D -
第7题:
计算题:称取纯CaCO30.5405g,用HCL溶解后在容量瓶中配成品率250ml溶液,吸取此溶液25.00ml,以紫脲酸铵作指示剂,用去20.50ml的EDTA溶液,计算EDTA的物质的量浓度。
正确答案: 解:反应式为CaCO3=2HCL=CaCl2+CO2+H2O
Ca2++H2Y2-=Ca2-+2H+
25.00/250×m(CaCO3)/M(CaCO3)=c(EDTA)V
即25.00/250×0.5405/100.1=C(EDTA)×20.50×10-3
即C(EDTA)=0.02634(mol/L)
EDTA溶液的物质量浓度为0.02634mol/L。 -
第8题:
用K2Cr2O7标定Na2S2O3时,若滴定至终点后,立即会出现回蓝现象,这是由于()
正确答案:K2Cr2O7与KI反应未完全所致 -
第9题:
用K2Cr2O7标定Na2S2O3时,如果K2Cr2O7与KI反应未完全就开始滴定,则滴定至终点后,立即会出现()现象。
正确答案:回蓝现象 -
第10题:
称取基准物质草酸(H2C2O4·2H2O)0.5987g溶解后,转入100mL容量瓶中定容,移取25.00mL用以标定NaOH标准溶液,用去NaOH溶液21.10mL。计算NaOH溶液的物质的量浓度()。
正确答案:0.1125mol·L-1 -
第11题:
填空题用K2Cr2O7标定Na2S2O3时,如果K2Cr2O7与KI反应未完全就开始滴定,则滴定至终点后,立即会出现()现象。正确答案: 回蓝现象解析: 暂无解析 -
第12题:
判断题用K2Cr2O7标定Na2S2O3时,如果K2Cr2O7与KI反应未完全就开始滴定,则滴定至终点后,立即会出回蓝现现象。A对
B错
正确答案: 错解析: 暂无解析 -
第13题:
用K2Cr2O7作基准物质标定Na2S2O3溶液时,要加入过量的KI和HCl溶液,放置一定时间后才能加水稀释,在滴定前还要加水稀释。
此题为判断题(对,错)。
正确答案:√
-
第14题:
称取邻苯二甲酸氢钾(KHP)基准物质0.6306g,标定NaOH溶液。以酚酞为指示剂滴定至终点,用去此溶液29.56mL,求NaOH物质的量浓度。
正确答案:
-
第15题:
称取0.1936g基准物K2Cr2O7溶于水,加酸酸化后加入足量的KI,暗处加盖反应5分钟后,然后用Na2S2O3滴定,消耗了33.61mL,则Na2S2O3溶液的浓度为()mol/L。(MK2Cr2O7=294.2)(提示:K2Cr2O7+6KI+14HCI=8KCl+2CrCl3+7H2O+3I2,2Na2S2O3十I2=Na2S4O6+2NaI)
- A、0.1100
- B、0.1175
- C、0.1263
- D、0.1264
正确答案:B -
第16题:
以K2Cr2O7为基准物,用间接碘量法来标定Na2S2O3溶液时,在用Na2S2O3滴定前,为什么要加大量水稀释?
正确答案:①K2Cr2O7和KI的反应要在强酸性溶液中进行,而Na2S2O3与I2的反应必须在中性或弱酸性溶液中进行,为防止Na2S2O3分解,必须加入大量的水稀释,以降低溶液的酸度。
②由于Cr2O72-的还原产物Cr3+显墨绿色,妨碍终点的观察,加水稀释后溶液中Cr3+浓度降低,颜色变浅,使终点易于观察。 -
第17题:
取烘干的基准物Na2CO30.1500g,溶于水,以甲基橙为指示剂,用HCl标准滴定溶液滴定至终点,消耗25.00mL,则HCl的浓度为()mol/L。
- A、0.05660
- B、0.1132
- C、0.1698
- D、0.2264
正确答案:B -
第18题:
称取0.1005g纯CaCO3溶解后,用容量瓶配成100.0mL溶液。吸取25.00mL,在pH>12时,用钙指示剂指示终点,用EDTA标准溶液滴定,用去24.90mL,试计算:EDTA溶液的浓度为();每1mLEDTA相当于ZnO()克、Fe2O3()克。
正确答案:0.01009mol·L-1;0.0008212g·mL-1;0.0008072g·mL-1 -
第19题:
NaHCO31.008g溶于适量水中,然后往此溶液中加入纯固体NaOH 0.3200g,最后将溶液移入250mL容量瓶中。移取上述溶液50.00mL,以0.100mol·L-1HCl溶液滴定。计算以酚酞为指示剂滴定至终点时,消耗HCl溶液()毫升,继续加入甲基橙指示剂滴定至终点时,又消耗HCl溶液()毫升。
正确答案:16.0;24.0 -
第20题:
以K2Cr2O7标定Na2S2O3浓度时,是使用间接碘量法,能否采用K2Cr2O7直接滴定Na2S2O3?为什么?
正确答案:在中性或微碱性中,S2O32-和I2反应生成S4O62-,该反应定量进行但K2Cr2O7与S2O32-的反应,在此条件下,作用不完全,有S析出,且反应速度较慢,故不能直接滴定。 -
第21题:
以K2Cr2O7标定Na2S2O3标准溶液时,滴定前加水稀释时是为了()。
- A、保持溶液的弱酸性
- B、防止淀粉凝聚
- C、防止碘挥发
- D、降低Cr3+浓度,便于终点观察
正确答案:A,D -
第22题:
单选题称取含有As2O3和As2O5的试样0.5000g,溶解后,在()溶液中用c(1/2I2)=0.1000mol/LI2溶液滴定至终点,消耗30.00mL。将此溶液调制(),加入过量KI,析出的I2用c(Na2S2O3)=0.3000mol/L的Na2S2O3溶液滴定至终点。A弱酸性、碱性
B弱碱性、酸性
C弱酸性、酸性
D弱碱性、碱性
正确答案: A解析: 暂无解析 -
第23题:
问答题以K2Cr2O7标定Na2S2O3浓度时,是使用间接碘量法,能否采用K2Cr2O7直接滴定Na2S2O3?为什么?正确答案: 在中性或微碱性中,S2O32-和I2反应生成S4O62-,该反应定量进行但K2Cr2O7与S2O32-的反应,在此条件下,作用不完全,有S析出,且反应速度较慢,故不能直接滴定。解析: 暂无解析 -
第24题:
单选题称取含有As2O3和As2O5的试样0.5000g,溶解后,在弱碱性溶液中用c(1/2I2)=0.1000mol/LI2溶液滴定至终点,消耗30.00mL。将此溶液用HCl调制酸性,加入过量KI,析出的I2用c(Na2S2O3)=0.3000mol/L的Na2S2O3溶液滴定至终点,消耗30.00mL。则试样中As2O3和As2O5的含量分别为()。已知M(As2O3)=197.8g/mol,M(As2O5)=229.84g/mol。A19.78%和45.96%
B9.89%和22.98%
C22.98%和9.89%
D45.96%和19.78%
正确答案: D解析: 暂无解析
