下列哪一项不是申办者在临床试验前必须准备和提供的?()A.试验用药品B.受试者的个人资料C.该药已有的临床资料D.该药的临床前研究资料
题目
下列哪一项不是申办者在临床试验前必须准备和提供的?()
A.试验用药品
B.受试者的个人资料
C.该药已有的临床资料
D.该药的临床前研究资料
相似考题
参考答案和解析
更多“下列哪一项不是申办者在临床试验前必须准备和提供的?()A.试验用药品B.受试者的个人资料C.该药已有的临床资料D.该药的临床前研究资料”相关问题
-
第1题:
下列哪一项不是申办者在临床试验前必须准备和提供的?()
A.试验用药品
B.该药临床研究资料
C.该药的质量检验结果
D.该药的稳定性试验结果
答案D -
第2题:
研究者必须保证所有试验药品仅用于该临床试验的受试者,其剂量与用法应遵照试验方案,剩余的试验药品退回申办者,整个过程需由专人负责并记录在案。()
答案√ -
第3题:
中国药物临床试验质量管理规范要点是A、药物临床试验前的准备与必要条件和受试者的权益保障
B、药物临床试验方案,研究者的职责,申办者和监察员的职责
C、记录与报告,数据管理与统计分析
D、试验用药品的管理质量保证
E、多中心临床试验
参考答案:ABCDE
-
第4题:
下列说法错误的是
A、研究者在临床试验前必须获得药品监督管理部门批准进行临床试验的批文
B、研究者在临床试验前必须获得药检部门对准备用于人体试验的该批新药的质量检验合格证明
C、研究者在临床试验前必须熟悉申办者所提供的与临床试验有关的资料与文献
D、研究者在临床试验前必须审查全部研究资料
E、参加研究的医师不需要掌握研究计划内容与要求
参考答案:E
-
第5题:
A.伦理委员会
B.受试者
C.申办者
D.药物临床试验机构
E.研究者提供试验经费的是答案:C解析:(1)申办者负责发起、申请、组织、监查和稽查一项临床试验,并提供试验经费。所以(1)题答案为C。(2)临床试验完成后,研究者必须写出总结报告,签名并注明日期后送申办者。所以(2)题答案为E。(3申办者提供研究者手册,其内容包括试验药物的化学、药学、毒理学、药理学和临床的(包括以前的和正在进行的试验)资料和数据。所以(3题答案为C。 -
第6题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD.50
E.临床前研究资料答案:E解析:新药进行临床试验必须提供临床前研究资料。 -
第7题:
临床试验前,申办者须提供试验药物已完成和其它地区正在进行与临床试验有关的有效性和安全性资料。
正确答案:正确 -
第8题:
研究者中止一项临床试验必须通知谁?()
- A、受试者
- B、申办者
- C、伦理委员会
- D、药品监督管理部门
正确答案:A,B,C,D -
第9题:
申办者应对参加临床试验的受试者提供什么保障?
正确答案:应提供保险,对于发生与试验相关的损害或死亡的受试者承担治疗的费用及相应的经济补偿。 -
第10题:
下列哪一项不是申办者在临床试验前必须准备和提供的?()
- A、试验用药品
- B、该试验临床前研究资料
- C、该药的质量检验结果
- D、该药的质量标准
正确答案:D -
第11题:
判断题研究者提前终止或暂停一项临床试验必须通知受试者、药政管理部门、申办者和伦理委员会,并述明理由。()A对
B错
正确答案: 对解析: 暂无解析 -
第12题:
判断题研究者所有的试验药品应用于该药品临床试验的受试者,但对于希望使用该药品的未入选试验的患者,可在研究者监护下使用该药。()A对
B错
正确答案: 错解析: 暂无解析 -
第13题:
研究者提前终止或暂停一项临床试验时,必须事先通知受试者、药政管理部门、申办者和伦理委员会,并述明理由。()
答案× -
第14题:
在药物临床试验的过程中,下列哪一项不是必须的A、保障受试者个人权益
B、保障试验的科学性
C、保障药品的有效性
D、保障试验的可靠性
E、保障申办方的权益
参考答案:C
-
第15题:
化学药品注册分类I类至V类新药审批的一般程序是( )。
A.提供符合规定的综述资料、药学研究资料药理毒理研究资料、临床研究资料,向SFDA申请临床试验批文
B.申办者选择或由SFDA指定具有资质的国家药品研究基地为临床研究单位
C.取得SFDA批文后进行临床研究(I、Ⅱ、Ⅲ期)
D.提供临床研究资料及临床前研究资料,经审评合格取得试生产批文,试生产期间进行药品生产质量观察及Ⅳ期临床试验,并在试生产满前3个月,提供有关资料申请转正
E.审批合格后转为正式生产
正确答案:ABCDE
-
第16题:
化学药品注册分类I至V类新药审批的一般程序是
A.提供符合规定的综述资料、药学研究资料、药理毒理研究资料、临床研究资料,向SFDA申请临床试验批文
B.申办者选择或由SFDA指定具有资质的国家药品研究基地为临床研究单位
C.取得SFDA批文后进行临床研究(Ⅰ、Ⅱ、Ⅲ期)
D.提供临床研究资料及临床前研究资料,经审评合格取得试生产批文试生产期间进行药品生产质量观察及Ⅳ期临床试验,并在试生产满前3个月,提供有关资料申请转正
E.审批合格后转为正式生产
正确答案:ABCDE
-
第17题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD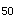
E.临床前研究资料答案:E解析: -
第18题:
观察人体对于新药的耐受程度和药动学,为制定给药方案提供依据A.Ⅰ期临床试验
B.Ⅱ期临床试验
C.Ⅲ期临床试验
D.临床前试验
E.生物等效性试验答案:A解析: -
第19题:
下述不正确的是()
- A、研究者在临床试验前必须获得药品监督管理部门批准进行临床试验的批文
- B、研究者在临床试验前必须获得药检部门对准备用于人体试验的该批新药的质量检验合格证明
- C、研究者在临床试验前必须审查全部研究资料
- D、研究者在临床试验前必须熟悉申办者所提供的与临床试验有关的资料与文献
- E、参加研究的医师不需要掌握研究计划内容与要求
正确答案:E -
第20题:
研究者提前终止或暂停一项临床试验必须通知受试者、药政管理部门、申办者和伦理委员会,并述明理由。()
正确答案:正确 -
第21题:
研究者所有的试验药品应用于该药品临床试验的受试者,但对于希望使用该药品的未入选试验的患者,可在研究者监护下使用该药。()
正确答案:错误 -
第22题:
单选题下述不正确的是()A研究者在临床试验前必须获得药品监督管理部门批准进行临床试验的批文
B研究者在临床试验前必须获得药检部门对准备用于人体试验的该批新药的质量检验合格证明
C研究者在临床试验前必须审查全部研究资料
D研究者在临床试验前必须熟悉申办者所提供的与临床试验有关的资料与文献
E参加研究的医师不需要掌握研究计划内容与要求
正确答案: E解析: 暂无解析 -
第23题:
单选题下列哪一项不是申办者在临床试验前必须准备和提供的?()A试验用药品
B该试验临床前研究资料
C该药的质量检验结果
D该药的质量标准
正确答案: C解析: 暂无解析
