某化学反应R→P在等压过程焓变DS与温度无关,则该过程的A.DU与温度无关B.DH与温度无关C.DF与温度无关D.DG与温度无关
题目
某化学反应R→P在等压过程焓变DS与温度无关,则该过程的
A.DU与温度无关
B.DH与温度无关
C.DF与温度无关
D.DG与温度无关
相似考题
更多“某化学反应R→P在等压过程焓变DS与温度无关,则该过程的”相关问题
-
第1题:
标准摩尔生成焓就是在温度和压力下进行反应的焓变。()
参考答案:错误
-
第2题:
有1mol刚性双原子分子理想气体,在等压过程中对外做功为W,则其温度变化ΔT为( )。A、 R/W
B、 W/R
C、 2R/W
D、 2W/R答案:B解析:质量一定的理想气体处于平衡态时的状态参量P、V、T之间的关系称为理想气体状态方程。理想气体状态方程式(克拉贝隆方程)为:pV=nRT,式中p是压力;V是体积;n是气体物质的量;T是热力学温度。pV=RT适用于1mol气体,该方程与气体的种类和工质经历的热力过程都无关。等压过程中,p=恒量,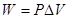
利用状态方程pV=RT,则有W=RΔT,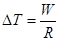
-
第3题:
关于熵和焓,以下说法正确的是()。
- A、物质的相对分子质量相近,其标准熵值相近
- B、反应过程的熵变只与始态和终态有关,与过程无关
- C、若化学反应的焓变小于0,熵变大于0,则反应必定向正方向进行
- D、热力学上298K时所有稳定单质的标准生成自由焓为零
正确答案:B,C,D -
第4题:
下列有关化学反应热说法正确的是()。
- A、恒压反应热指的是在恒压和恒温条件下,反应物按化学反应计量式完全反应引起的物料在反应前后的焓差
- B、化学反应热是温度和压力的函数。当压力不太高时,可认为化学反应热与压力无关
- C、对同一化学反应,若化学反应计量方程式的系数不同,则化学反应热的数值也不相同
- D、化学反应热与反应物和产物的凝聚状态无关
正确答案:A,B,C -
第5题:
对于热化学反应方程,表述正确的有()
- A、不同组分表示的化学反应进度相同
- B、反应进度与方程式书写无关
- C、化学反应焓变与方程式书写形式无关
- D、化学反应摩尔焓变与反应方程式书写形式无关
正确答案:A,D -
第6题:
化学反应的焓变只与物质的始终态有关,而与变化途径无关。
正确答案:正确 -
第7题:
焓变与()无关。
- A、物质所处环境的压强
- B、物质所处环境的温度
- C、化学反应的过程
- D、化学反应起止状态
正确答案:C -
第8题:
某化学反应A+B→P 的速率方程是r=KCACB2,该反应的反应级数等于()
正确答案:3 -
第9题:
涉及焓的下列说法中正确的是()
- A、单质的焓值均为零
- B、在等温过程中焓变为零
- C、在绝热可逆过程中焓变为零
- D、化学反应中体系的焓变不一定大于内能变化
正确答案:D -
第10题:
多选题下列有关化学反应热说法正确的是()。A恒压反应热指的是在恒压和恒温条件下,反应物按化学反应计量式完全反应引起的物料在反应前后的焓差
B化学反应热是温度和压力的函数。当压力不太高时,可认为化学反应热与压力无关
C对同一化学反应,若化学反应计量方程式的系数不同,则化学反应热的数值也不相同
D化学反应热与反应物和产物的凝聚状态无关
正确答案: C,D解析: 暂无解析 -
第11题:
单选题某理想气体经历了一个内能不变的热力过程,则该过程中工质的焓变( )。A大于零
B等于零
C小于零
D不确定
正确答案: C解析:
理想气体的内能和焓均是温度的单值函数,因此内能不变的热力过程即为温度不变的热力过程,所以该过程焓变为零。 -
第12题:
单选题有1mol刚性双原子分子理想气体,在等压过程中对外做功为W,则其温度变化ΔT为( )。[2014年真题]AR/W
BW/R
C2R/W
D2W/R
正确答案: B解析:
等压过程中,p=恒量,W=PΔV,利用状态方程pV=RT,有:W=RΔT,ΔT=W/R。 -
第13题:
气体CO与O2在一坚固的绝热箱内发生化学反应,系统的温度升高,该过程( )
A.DU=0;
B.DH=0;
C.DS=0;
D.DG=0
正确答案:A
-
第14题:
化学反应在任何温度下都不能自发进行时,其()
- A、焓变和熵变两者都是负的;
- B、焓变和熵变两者都是正的;
- C、焓变是正的,熵变是负的;
- D、焓变是负的,熵变是正的.
正确答案:C -
第15题:
对理想气体,下列描述不正确的是()。
- A、焓与熵都随温度而变
- B、焓与熵都随压力而变
- C、焓随温度而变,与压力无关
- D、熵随温度而变,也随压力而变
正确答案:B -
第16题:
一位化学教师正在教授“化学反应原理”这个模块,他在备课的过程中发现新教材引入了焓变的概念.于是他产生了一个疑问:既然焓变的大小等于等压过程反应热,那么既然已经给学生建立了反应热的认识.为什么还要引入“焓变”呢?(1)请写出焓的定义式,并说明其含义。(2)为什么有了反应热,还需要引入焓变?它的作用是什么?
正确答案: (1)H=U+pV,U是体系的内能,p是体系的压强,V是体系的体积。由于我们不能确定体系内能的绝对值,所以也不能确定焓的绝对值。焓是状态函数,具有能量量纲,但是没有明确的物理意义。焓完全是化学家为了便于计算特定条件下的反应热而定义出的一个体系的热力学性质。
(2)等压过程的反应热(Q)是可以通过实验测量的,但每一个反应的Q都必须通过实验测量;引入焓变后,可以利用盖斯定律通过焓变的计算得到没有经过实验测定的反应的反应热;焓变是状态函数,在此基础上定义的物质的标准生成焓,具有重要意义。 -
第17题:
某电池在298K、pθ下可逆放电时,放出100J的热量,则该电池反应的焓变值ΔrHm为:()
- A、100J
- B、>100J
- C、<-100J
- D、-100J
正确答案:C -
第18题:
涉及焓的下列说法中正确的是()
- A、单质的焓值均等于零
- B、在等温过程中焓变为零
- C、在绝热可逆过程中焓变为零
- D、化学反应中系统的焓变不一定大于内能变化
正确答案:D -
第19题:
某体系在非等压过程中加热,吸热Q,使温度从T1升到T2,则此过程的焓增量H:()
- A、H=Q
- B、H=0
- C、H=U+(pV)
- D、H等于别的值。
正确答案:C -
第20题:
某化学反应在恒压、绝热和只做膨胀功的条件下进行,系统温度由T1升高到T2,则此过程的焓变()零;若此反应在恒温(T1)、恒压和只做膨胀功的条件下进行,则其焓变()零。
正确答案:等于;不等于(小于) -
第21题:
某体系等压过程A→B的焓变△H与温度T无关,则该过程的:()
- A、△U与温度无关;
- B、△与温度无关;
- C、△F与温度无关;
- D、△G与温度无关。
正确答案:B -
第22题:
单选题焓变与()无关。A物质所处环境的压强
B物质所处环境的温度
C化学反应的过程
D化学反应起止状态
正确答案: C解析: 暂无解析 -
第23题:
单选题对理想气体,下列描述不正确的是()。A焓与熵都随温度而变
B焓与熵都随压力而变
C焓随温度而变,与压力无关
D熵随温度而变,也随压力而变
正确答案: B解析: 暂无解析 -
第24题:
问答题一位化学教师正在教授“化学反应原理”这个模块,他在备课的过程中发现新教材引入了焓变的概念.于是他产生了一个疑问:既然焓变的大小等于等压过程反应热,那么既然已经给学生建立了反应热的认识.为什么还要引入“焓变”呢?(1)请写出焓的定义式,并说明其含义。(2)为什么有了反应热,还需要引入焓变?它的作用是什么?正确答案: (1)H=U+pV,U是体系的内能,p是体系的压强,V是体系的体积。由于我们不能确定体系内能的绝对值,所以也不能确定焓的绝对值。焓是状态函数,具有能量量纲,但是没有明确的物理意义。焓完全是化学家为了便于计算特定条件下的反应热而定义出的一个体系的热力学性质。
(2)等压过程的反应热(Q)是可以通过实验测量的,但每一个反应的Q都必须通过实验测量;引入焓变后,可以利用盖斯定律通过焓变的计算得到没有经过实验测定的反应的反应热;焓变是状态函数,在此基础上定义的物质的标准生成焓,具有重要意义。解析: 暂无解析
