分子轨道理论假设原子所有的电子都会参与到分子的成键之中
题目
分子轨道理论假设原子所有的电子都会参与到分子的成键之中
相似考题
更多“分子轨道理论假设原子所有的电子都会参与到分子的成键之中”相关问题
-
第1题:
在下列物质的分子中,中心原子采用sp杂化轨道成键,分子空间构型是直线型的是( )。A.
B.
C.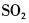
D.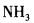 答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。
答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。 -
第2题:
20世纪30年代,人们把量子力学的原理推广到多原子分子的研究上来。建立了两种化学键理论,它们是()
- A、价键理论和分子轨道理论
- B、量子力学和量子化学理论
- C、杂化轨道和分析理论
- D、核物理和控制理论
正确答案:A -
第3题:
下面选项中说法不正确的为()
- A、σ键的一对成键电子的电子密度分布对键轴方向呈园柱型对称
- B、σ键电子云分布是对通过键轴的平面呈镜面对称
- C、σ键比π键活泼性高,易参与化学反应
- D、配位键只能在分子内原子之间形成,不可以在分子间形成
- E、成键电子的原子轨道重叠程度越大,所形成的共价键越牢固
正确答案:C,D -
第4题:
SnCl2分子和H2O分子的空间构型均为V型,表明它们的中心原子采取相同方式的杂化轨道成键。
正确答案:错误 -
第5题:
凡是配位数为4的分子,其中心原子均采用sp3杂化轨道成键。
正确答案:错误 -
第6题:
按照杂化轨道理论,在CH4分子中,C原子采用sp3杂化轨道与H原子的1s轨道成键,形成一个空间构型为正四面体的分子。H2O分子中O原子用不等性sp3杂化轨道成键,分子的几何构型是()。
正确答案:V字型 -
第7题:
BF3分子使用()杂化轨道成键,所以分子构型为();而NF3分子使用()杂化轨道成键,所以分子构型是()。
正确答案:sp2;三角形;不等性sp3;三角锥形 -
第8题:
水是食品的重要组成成成分,其H2O分子中氧原子的()个价电子参与杂化,形成()个()杂化轨道,分子有()体构型,两个H-O键之间的夹角为()。
正确答案:SP3;109;5° -
第9题:
自由基是指()
- A、极易被电离的原子、原子团和分子
- B、极易起氧化还原反应的原子、原子团和分子
- C、具有单价的原子、原子团和分子
- D、外层轨道上具有配对电子的原子、原子团和分子
- E、外层轨道上具有不配对电子的原子、原子团和分子
正确答案:E -
第10题:
单选题自由基是指()A极易被电离的原子、原子团和分子
B极易起氧化还原反应的原子、原子团和分子
C具有单价的原子、原子团和分子
D外层轨道上具有配对电子的原子、原子团和分子
E外层轨道上具有不配对电子、原子团和分子
正确答案: D解析: 自由基是指外层轨道上具有单个不配对电子的原子、原子团和分子的总称。 -
第11题:
单选题按价键理论,下列分子中的中心原子在成键时必须拆开电子对的是( )。ANCl3
BH2O
CBCl3
DSO2
正确答案: D解析:
NCl3中心N原子价层电子构型为2s22p3,2p轨道有3个单电子,与3个Cl形成3个σ键;H2O中心O原子价层电子构型为2s22p4,2p轨道有2个单电子,与2个H形成2个σ键;同理,SO2中心S原子的2p轨道有2个单电子,与2个O形成2个σ键;而BCl3中心B原子价层电子构型为2s22p1,2p轨道有一个单电子,与3个Cl形成3个σ键时,缺少2个单电子,需将2s轨道2个电子中的一个激发到2p轨道上,使中心原子有3个单电子分别与Cl成σ键,即BCl3中心B原子在形成分子时必须将2s轨道两个电子拆开。 -
第12题:
单选题自由基是指()A极易被电离的原子、原子团和分子
B极易起氧化还原反应的原子、原子团和分子
C具有单价的原子、原子团和分子
D外层轨道上具有配对电子的原子、原子团和分子
E外层轨道上具有不配对电子的原子、原子团和分子
正确答案: A解析: 暂无解析 -
第13题:
按照量子力学原理,以及共价键的成键原则,阐述原子轨道组合成分子轨道的原则?
正确答案: ⑴能量近似原则:只有能量相近(包括相等、相同)的原子轨道才可以组合。
⑵最大重叠原则:因为形成共价键时,只有轨道最大限度的重叠,才可以使体系的能量降低最多,体系趋于稳定。
⑶对称性原则:原子轨道的组合是核外电子运动的波函数的组合,按照共价键的成键原则,必须波函数位相相同的轨道才可以重叠成键,所以,轨道的组合必须对称性允许。 -
第14题:
下列各题说法不正确的是()
- A、两个原子的P电子只能沿P轨道对称轴平行方式重叠形成π键
- B、极性键只能形成极性分子;
- C、非极性键形成非极性分子
- D、形成配位键的条件是一方有空轨道,另一方有孤对电子
- E、共价键形成的条件是欲成键原子必须有未成对电子
正确答案:A,B -
第15题:
MO法中成键电子数与反键电子数之差的一半就是分子的键级.键级的大小表示两个相邻原子之间成键的(),键级越大,键越()
正确答案:强度;稳定 -
第16题:
能形成共价分子的主族元素,其原子的内层d轨道均被电子占满,所以不可能用内层d轨道参与形成杂化轨道。
正确答案:正确 -
第17题:
以极性键结合的双原子分子里,共用电子对偏向某个原子,使两个原子分别显正、负电性,这样的分子叫()
- A、非极性分子
- B、极性分子
- C、极性键
- D、非极性键
正确答案:B -
第18题:
根据分子轨道理论,分子轨道是由()线性组合而成,分子中的电子是在()中运动,而不属于某个原子。
正确答案:原子轨道;分子轨道 -
第19题:
对于乙烯分子的形成,下列叙述正确的是()。
- A、2个碳原子各以1个sp2杂化轨道“肩并肩”重叠,形成1个C-Cσ键
- B、乙烯分子中有6个C-Hσ键
- C、乙烯分子中形成Л键的一对电子叫Л电子
- D、以“头碰头”重叠形成的键称为Л键
正确答案:C -
第20题:
原子间成键时,同一原子中能量相近的某些原子轨道要先杂化,其原因是()
- A、保持共价键的方向性;
- B、进行电子重排
- C、增加成键能力;
- D、使不能成键的原子轨道能够成键.
正确答案:C -
第21题:
原子形成分子时,原子轨道之所以要进行杂化,其原因是()。
- A、进行电子重排
- B、增加配对的电子数
- C、增加成键能力
- D、保持共价键的方向
正确答案:C -
第22题:
问答题按照量子力学原理,以及共价键的成键原则,阐述原子轨道组合成分子轨道的原则?正确答案: ⑴能量近似原则:只有能量相近(包括相等、相同)的原子轨道才可以组合。
⑵最大重叠原则:因为形成共价键时,只有轨道最大限度的重叠,才可以使体系的能量降低最多,体系趋于稳定。
⑶对称性原则:原子轨道的组合是核外电子运动的波函数的组合,按照共价键的成键原则,必须波函数位相相同的轨道才可以重叠成键,所以,轨道的组合必须对称性允许。解析: 暂无解析 -
第23题:
单选题用分子轨道理论来判断下列说法,不正确的是()AN2+的键级比N2分子的小
BCO+键级是2.5
CN2-和O2+是等电子体
D在第二周期同核双原子分子中,Be2分子能稳定存在
正确答案: A解析: 暂无解析 -
第24题:
填空题水是食品的重要组成成成分,其H2O分子中氧原子的()个价电子参与杂化,形成()个()杂化轨道,分子有()体构型,两个H-O键之间的夹角为()。正确答案: SP3,109,5°解析: 暂无解析
