用0.5000 g煤试样,将其中的硫完全氧化成SO42-,处理成溶液并除去重金属离子后,加入0.050 00 mol·L-1BaCl2溶液20.00 mL,使之生成BaSO4沉淀,过量的Ba2+ 用0.025 00 mol·L-1 EDTA滴定用去20.00 mL,计算此煤中硫的质量分数。(已知:M(S) = 32.00 g·mol-1)
题目
用0.5000 g煤试样,将其中的硫完全氧化成SO42-,处理成溶液并除去重金属离子后,加入0.050 00 mol·L-1BaCl2溶液20.00 mL,使之生成BaSO4沉淀,过量的Ba2+ 用0.025 00 mol·L-1 EDTA滴定用去20.00 mL,计算此煤中硫的质量分数。(已知:M(S) = 32.00 g·mol-1)
相似考题
参考答案和解析
更多“用0.5000 g煤试样,将其中的硫完全氧化成SO42-,处理成溶液并除去重金属离子后,加入0.050 00 mol·L-1BaCl2溶液20.00 mL,使之生成BaSO4沉淀,过量的Ba2+ 用0.025 00 mol·L-1 EDTA滴定用去20.00 mL,计算此煤中硫的质量分数。(已知:M(S) = 32.00 g·mol-1)”相关问题
-
第1题:
称取Pb3O40.1000g,以HCl溶液溶解,加热下,用过量K2Cr2O7将Pb2+沉淀完全,反应为2Pb2++Cr2O72-+H2O ↔2PbCrO4↓+2H+,冷却后过滤洗涤,将PbCrO4沉淀以HCl溶液溶解,加入过量KI,用0.1000mol·L-1Na2S2O3溶液滴定,终点时用去12.00ml,求试样中Pb3O4的质量分数。 [M(Pb3O4)=685.6g·mol-1]参考答案:
-
第2题:
将0.56g含钙试样溶解成250mL试液,移取25mL试液,用0.02mol×L-1的EDTA标准溶液滴定,耗去30mL,则试样中CaO(M=56g×mol-1)含量约为()。A、6%
B、12%
C、30%
D、60%
参考答案:D
-
第3题:
将1.000g钢样中的铬转化为Cr2</sub>O7</sub>2-</sup>后,加入过量的0.05000mol·L-1</sup>FeSO4</sub>溶液20.00mL,再用0.01006mol·L-1</sup>KMnO4</sub>溶液回滴,用去5.55mL,求样品中Cr的质量分数。答案: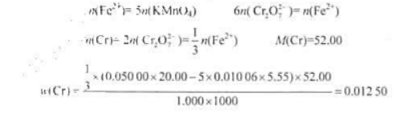
-
第4题:
利用配位滴定法测定无机盐中的SO42-时,加入定量过量的BaCl2溶液,使生成BaSO4沉淀,剩余的Ba2+用EDTA标准滴定溶液滴定,则有n(SO42-)=n(Ba2+);n(Ba2+)=n(EDTA)。()此题为判断题(对,错)。
参考答案:正确
-
第5题:
含硫有机试样0.471g,在氧气中燃烧使硫氧化为SO2,用预先中和过的H2O2吸收SO2,全部转化成H2SO4,以c(KOH)=0.108mol/L溶液滴定,消耗28.20mL至终点,其试样中硫的含量为()(Ms=32.00g/mol)。
- A、10%
- B、10.3%
- C、10.34%
- D、10.35%
正确答案:B -
第6题:
现有一低合金钢,称取试样0.5000g,用SP混酸溶解,以过硫酸铵-硝酸银氧化,以尿素-NaNO2还原,用0.01000mol/L的亚铁滴定,滴定用去标准溶液20.20ml,试计算此试样中铬的质量分数(%)。(相对原子质量:Cr=52.0g)
正确答案: 解:Cr%=C×V×M×100/G
=(0.01000×20.20×52.0×100)/(3×1000×0.5000)
=0.70(%)
答:此试样中铬的质量分数为0.70% -
第7题:
将0.56g含钙试样溶解成250mL试液,用0.02mol/L的EDTA溶液滴定,消耗30mL,则试样中CaO的含量为()。M(Ca)=56g/mol
- A、3%
- B、6%
- C、12%
- D、30%
正确答案:B -
第8题:
计算题:取欲标定的NaOH溶液20.00mL,用C(HCL)=0.1010mol/L的标准溶液标定,用去HCL溶液19.8mL,计算C(NaOH)为多少?
正确答案: 解:C(NaOH)=0.1010×19.8÷20.00=0.1000(mol/L)
C(NaOH)为0.1000mol/L。 -
第9题:
现有100.0ml浓度为0.1000mol·L-1的某一元有机弱酸,用25.0ml苯萃取后,取水相25.0ml,用0.02000mol·L-1的NaOH标准溶液滴定,用去了20.00ml,求该有机弱酸的分配系数()。
正确答案:21.0 -
第10题:
用凯氏定氮法测定蛋白质的含氮量,称取粗蛋白试样1.658g,将试样中的氮转变为NH3并以25.00mL0.2018mol·L-1的HCl标准溶液吸收,剩余的HCl以0.1600mol·L-1NaOH标准溶液返滴定,用去NaOH溶液9.15mL,计算此粗蛋白试样中氮的质量分数()。
正确答案:0.03025 -
第11题:
单选题称取含有PbO和PbO2的试样1.234g,用20.00mL0.2500mol/LH2C2O4溶液处理,此时Pb(Ⅳ)被还原为Pb2+,将溶液中和,使Pb2+定量沉淀为PbC2O2,过滤,将滤液酸化,以c(1/5KMnO4)=0.2000mol/LKMnO4标准滴定溶液滴定,用去10.00mL。沉淀以酸溶解,用相同浓度KMnO4滴定,消耗30.00mL,则试样中PbO2的含量为()。已知:M(PbO)=223.2g/mol,M(PbO2)=239.0g/mol。A9.68%
B19.37%
C36.18%
D38.74%
正确答案: C解析: 暂无解析 -
第12题:
单选题溴酸盐剩余量滴定法是将试样用冰乙酸和水溶解后,()。A加入已知过量的碘化钾标准溶液,待反应完全后,加入溴酸钾—碘化钾,用硫代硫酸钠标准溶液滴定
B加入已知过量的硫代硫酸钠标准溶液,待反应完全后,加入溴酸钾,用碘化钾标准溶液滴定
C加入已知过量的溴酸钾—溴化钾标准溶液,待反应完全后,加入碘化钾,用硫代硫酸钠标准溶液滴定
D加入已知过量的硫代硫酸钠标准溶液,待反应完全后,加入溴酸钾—溴化钾,用碘化钾标准溶液滴定
正确答案: A解析: 暂无解析 -
第13题:
称取含有苯酚试样0.5000g,溶解后加入0.1000mol/LKBrO3(其中含有过量的KBr)25.00mL,加酸酸化后,放置待反应完全,加入过量的KI。用0.1003mol/LNa2S2O3溶液滴定析出的I2,用去29.91mL。求苯酚含量()A、30.68%
B、37.64%
C、28.98%
D、39.38%
正确答案:B
-
第14题:
用0.02000mol×L-1的EDTA溶液滴定含有0.1000gZnSO4(M=161.4g×/mol)试样溶液时,耗去25.00mL,则试样中ZnSO4的含量为()
A、99.00%
B、80.70%
C、40.35%
D、8.07%
参考答案:B
-
第15题:
利用配位定法测定无机盐中的SO42-时,加入定量过量的BaCl2溶液,使生成BaSO4沉淀,剩余的Ba2+用EDTA标准滴定溶液滴定,则有n(SO42-)=n(Ba2+)=n(EDTA)。()此题为判断题(对,错)。
参考答案:错误
-
第16题:
称取试样1.000g溶解,将其中的磷沉淀为磷钼酸铵,用20.00mL,0.1000mol·L-1NaOH溶解沉淀,过量的NaOH用0.2000mol·L-1HNO3,7.50mL滴至酚酞终点,计算试样中w(P)、w(P2O5)。 已知:
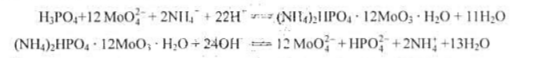 答案:
答案:
-
第17题:
称取0.5000克的煤试样,灼烧并使其中的硫完全氧化成为SO42-。处理成溶液并除去重金属离子后,加入0.05000mol·L-1BaCl220.00mL使之生成BaSO4沉淀。过量的Ba2+用0.02500mol·L-1EDTA滴定,用去20.00mL,计算煤中硫的百分含量为()。
正确答案:3.21% -
第18题:
称取大理石(CaCO3)试样0.2500g,用HCL溶解,加入PH=10的缓冲溶液和少许K--B指示剂,用CEDAT=0.1000mol/L的EDTA溶液滴定至终点时,消耗25.00ml,计算试样中CaO的质量分数是多少?
正确答案: 解:CaO%=(C×V×CaO×100)/(G×1000)
=(0.1000×25.00×56.08×100)/(0.2500×1000)=56.08(%)
答:试样中CaO的质量分数是56.08%。 -
第19题:
粗钠盐1.000g,加过量KOH溶液,产生的氨经蒸馏吸收在50.00mL的0.5000mol/L的HCl中,过量的用0.5000mol/L的Na0H回滴,用去1.56mL,试样中NH3的质量分数W(NH3)为()。(M(NH3)=17.03)
- A、41.25%
- B、41.2%
- C、40.01%
- D、40.0%
正确答案:A -
第20题:
称取0.5000g煤试样,熔融并使其中硫完全氧化成SO42-。溶解并除去重金属离子后。加入0.05000moL•L-1BaCl220.00mL,使生成BaSO4沉淀。过量的Ba2+用0.02500moL•L-1EDTA滴定,用去20.00mL。计算试样中硫的质量分数。(S:M=32.07)
正确答案:S(%)=(0.05000×20.00-0.02500×20.00)×10-3×32.07/0.5000=3.207(%) -
第21题:
现拟用0.0500mol·L-1硫酸沉淀15.0mL、0.0500mol·L-1BaCl2中的Ba2+,计算所需硫酸的体积是()。
正确答案:15.0mL -
第22题:
单选题称取含Cr和Mn的钢样0.8000g,经处理后,得到Fe3+、Cr2O2-7和Mn2+溶液。在F-存在时,用0.005000mol/LKMnO4标准滴定溶液滴定,此时Mn(Ⅱ)变成Mn(Ⅲ),用去KMnO4溶液20.00mL。然后将此溶液继续用0.04000mol/LFe2+标准滴定溶液滴定,用去30.00mL。则试样中Cr和Mn的含量分别为()。已知M(Cr)=51.996g/mol,M(Mn)=54.94g/mol。A5.50%和3.04%
B2.75%和1.52%
C1.52%和2.75%
D3.04%和5.50%
正确答案: C解析: 暂无解析 -
第23题:
问答题称取0.5000g煤试样,熔融并使其中硫完全氧化成SO42-。溶解并除去重金属离子后。加入0.05000moL•L-1BaCl220.00mL,使生成BaSO4沉淀。过量的Ba2+用0.02500moL•L-1EDTA滴定,用去20.00mL。计算试样中硫的质量分数。(S:M=32.07)正确答案: S(%)=(0.05000×20.00-0.02500×20.00)×10-3×32.07/0.5000=3.207(%)解析: 暂无解析 -
第24题:
问答题计算题: 测定某工业烧碱中NaOH和Na2CO3的质量分数,称取试样2.546g,溶于水并定容于250mL容量瓶中,取出25.00mL,以甲基橙为指示剂,滴定到橙色时,用去HCl标准溶液24.86mL。另取25.00mL溶液,加入过量BaCl2,以酚酞为指示剂,滴定到红色刚褪,用去HCl标准溶液23.74mL,又知中和0.4852g硼砂(Na2B4O7•10H2O)需要此HCl标准溶液24.37mL。计算该试样NaOH和Na2CO3的质量分数。 [M(Na2B4O7•10H2O)=381.4g•mol-1,Mr(NaOH)=40.00,M(Na2CO3)=106.0g•mol-1]正确答案: c(HCl)=0.1044mol•L-1
w(NaOH)=×100%=38.94%
w(Na2CO3)=×100%=2.43%解析: 暂无解析
