使H2(g)与O2(g)在绝热刚性密闭容器中完全反应,该过程中应有()A.ΔT=0B.Δ p =0C.ΔU=0D.ΔH=0
题目
使H2(g)与O2(g)在绝热刚性密闭容器中完全反应,该过程中应有()
A.ΔT=0
B.Δ p =0
C.ΔU=0
D.ΔH=0
相似考题
更多“使H2(g)与O2(g)在绝热刚性密闭容器中完全反应,该过程中应有()”相关问题
-
第1题:
在某温度下,一密闭的刚性容器中的PCl5(g)达到分解平衡,若往此容器中充入N2(g)使体系压力增大二倍(此时体系仍可按理想气体处理),则PCl5(g)的离解度将
A、增大
B、减小
C、不变
D、视温度而定
参考答案:C
-
第2题:
在密闭容器中进行反应:X(g)+2Y(g)?2Z(g)△ H>0.下图能正确表示该反应有关物理量变化规律的是(?? ) ? ?
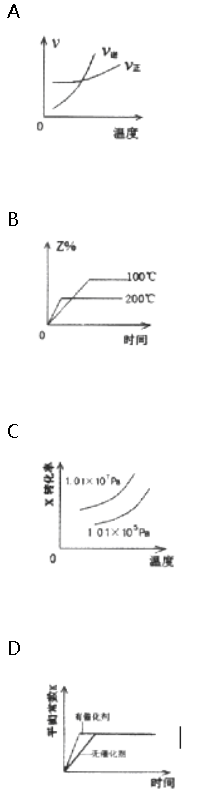 答案:C解析:A.该反应为吸热反应,升高温度平衡正向移动,正反应速率大于逆反应速率,则交叉点后应正反应速率在上方,与图象不符,故A错误;
答案:C解析:A.该反应为吸热反应,升高温度平衡正向移动,正反应速率大于逆反应速率,则交叉点后应正反应速率在上方,与图象不符,故A错误;
B.升高温度平衡正向移动,Z%增大,则200℃时Z%大,与图象不符,故B错误;
C.该反应为气体体积减小的反应,增大压强、升高温度,平衡均正向移动,X的转化率大,与图象一致,故C正确;
D.催化剂对平衡移动无影响,可加快反应速率,但平衡常数与温度有关,使用催化剂平衡常数K不变,与图象不符,故D错误;
故选C. -
第3题:
气体CO与O2在一坚固的绝热箱内发生化学反应,系统的温度升高,该过程()
- A、△U=0;
- B、△H=0;
- C、△S=0;
- D、△G=0
正确答案:A -
第4题:
H2和O2以2:1的比例在绝热的钢瓶中反应而生成水,在该过程中正确的是()。
- A、△H=0;
- B、△T=0;
- C、△p=0;
- D、△U=0。
正确答案:D -
第5题:
已知下列反应的平衡常数: H2(g)+S(s)=H2S(g) KØ1 S(s)+O2(g)=SO2(g) KØ2 则反应 H2(g)+SO2(g)=O2(g)+H2S(g)的标准平衡常数()
- A、KØ1/ KØ2
- B、KØ2/KØ1
- C、KØ1· KØ2
- D、KØ1- KØ2
正确答案:A -
第6题:
H2和O2以2︰1的摩尔比在绝热的钢瓶中反应生成H2O,在该过程中()是正确的。
- A、ΔH=0
- B、ΔT=0
- C、pVγ=常数
- D、ΔU=0
正确答案:D -
第7题:
将H2(g)与O2以2:1的比例在绝热刚性密闭容器中完全反应,则该过程中应有()
- A、ΔT=0
- B、Δp=0
- C、ΔU=0
- D、ΔH=0
正确答案:C -
第8题:
H2和O2在绝热恒容的钢瓶中发生反应()
- A、ΔU=0
- B、ΔH=0
- C、ΔS=0
- D、ΔG=0
正确答案:A -
第9题:
在刚性密闭容器中,有下列理想气体的反应达到平衡 A(g) + B(g) =C(g) 若在恒温下加入一定量的惰性气体,则平衡将:()
- A、向右移动
- B、向左移动
- C、不移动
- D、无法确定
正确答案:C -
第10题:
H2和O2在绝热钢筒中反应生成水,则下述状态函数的增量何者为零?()
- A、ΔU=0
- B、ΔH=0
- C、ΔS=0
- D、ΔA=0
- E、ΔG=0
正确答案:A -
第11题:
填空题下述3个反应: (1)S(s)+O2(g)→SO2(g) (2)H2(g)+O2(g)→H2O2(g) (3)C(s)+H2O(g)→CO2(g)+H2(g) 按ΔrSθm增加的顺序为()。正确答案: (3)>(1)>(2)解析: 暂无解析 -
第12题:
填空题反应2CO(g)+O2(g)=2CO2(g)为放热反应,在一密闭容器内,当反应达到平衡时,若向体系内加入CO2(g),平衡()移动;若降低温度,平衡()移动;若加入催化剂,平衡()移动正确答案: 向左,向右,不解析: 暂无解析 -
第13题:
若反应H2(g)+S(s)=H2S(g)平衡常数为,S(s)+O2(g)=SO2(g)的平衡常数为则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数-B.C.=131.3kJ·mol-1,=134.1J·K-1·mol-1,在标准状态下该反应()。A.在温度升高至一定数值以上即可自发进行
B.在温度降低至一定数值以上即可自发进行
C.在任何温度下反应都能自发进行
D.在任何温度下反应都不能自发进行
正确答案:D
-
第14题:
在一定温度下,将1.0molN2O4(g)放入一密闭容器中,当反应N2O4(g)↔2NO2(g)达到平衡时,容器内有0.8molNO2,气体总压为100.0kPa,则该反应的KΘ为()
- A、0.76
- B、1.3
- C、0.67
- D、4.0
正确答案:A -
第15题:
气体CO与O2在一坚固的绝热箱内发生化学反应,系统的温度升高,则该过程()。
- A、△U=0
- B、△H=0
- C、△S=0
- D、△G=0
正确答案:A -
第16题:
H2(g)和O2(g)在绝热钢瓶中反应生成水,W(),Q(),ΔU()。
正确答案:=0;=0;=0 -
第17题:
下面的说法符合热力学第一定律的是()
- A、在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化
- B、在无功过程中,内能变化等于过程热,这表明内能增量不一定与热力学过程无关
- C、封闭系统在指定的两个平衡态之间经历绝热变化时,系统所做的功与途径无关
- D、气体在绝热膨胀或绝热压缩过程中,其内能的变化值与过程完成的方式无关
正确答案:C -
第18题:
已知下列反应的平衡常数: H2(g)+S(s)=H2S(g)①K1; S(s)+O2(g)=SO2(g)②K2。 则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数为:()
- A、K1+K2
- B、K1-K2
- C、K1·K2
- D、K1/K2
正确答案:D -
第19题:
已知下列反应的平衡常数:H(+ S (s) == H2S 2g)(g) K1;S (s) + O2 (g) == SO2 (g) K2;则反应H2(g)+ SO2 (g) == O2 (g) + H2S (g)的平衡常数为 ()。
正确答案:K=K1/K2 -
第20题:
若反应 C(s)+O2(g)=CO2(g)在恒温、恒压条件下发生,其△rHm<0,若在恒容绝热反应中发生,则△rUm()0,△rSm()0
正确答案:=;> -
第21题:
判断在一个封闭的绝热刚性容器中的化学反应aA+bB→gG是否可自发进行,可用()
- A、ΔA判据
- B、ΔS判据
- C、ΔG判据
- D、(ΔS +ΔS环)判据
正确答案:B,D -
第22题:
在绝热、恒压、W=0的封闭系统内发生下列反应:H2(g)+0.5O2(g)→H2O(g)使系统的温度升高、体积为大。此过程的W()0;U()0;H()0;S()0。
正确答案:<;<;=;> -
第23题:
单选题下面的说法符合热力学第一定律的是()A在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化
B在无功过程中,内能变化等于过程热,这表明内能增量不一定与热力学过程无关
C封闭系统在指定的两个平衡态之间经历绝热变化时,系统所做的功与途径无关
D气体在绝热膨胀或绝热压缩过程中,其内能的变化值与过程完成的方式无关
正确答案: A解析: 因绝热时ΔU=Q+W=W。(A)中无热交换、无体积功故ΔU=Q+W=0。(B)在无功过程中ΔU=Q,说明始末态相同热有定值,并不说明内能的变化与过程有关。(D)中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU亦是不同的。这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。 -
第24题:
单选题H2(g)和O2(g)在绝热钢瓶中反应生成水,则( )。AΔH=0
BΔU=0
CΔS=0
DΔG=0
正确答案: A解析:
A项,因为是绝热钢瓶中的放热反应,气体分子数减少,所以ΔH<0。B项,因为钢瓶体积固定,且为绝热系统,与外界没有功和热的交换,故ΔU=0。C项,H2和O2生成水,其ΔS<0。D项,H2和O2生成水的反应并未指明处于平衡状态,故ΔG不一定为0。
