NA为阿伏加德罗常数,下列对0.3mol/L的22SO4溶液的说法中,正确的是()A、1L溶液中含0.3NA个钾离子B、1L溶液中含0.9NA个离子(K+、SO42-)C、2L溶液中钾离子浓度是1.2mol/LD、2L溶液中含0.6NA个离子(K+、SO42-)
题目
NA为阿伏加德罗常数,下列对0.3mol/L的22SO4溶液的说法中,正确的是()
- A、1L溶液中含0.3NA个钾离子
- B、1L溶液中含0.9NA个离子(K+、SO42-)
- C、2L溶液中钾离子浓度是1.2mol/L
- D、2L溶液中含0.6NA个离子(K+、SO42-)
相似考题
更多“NA为阿伏加德罗常数,下列对0.3mol/L的<sub>2</s”相关问题
-
第1题:
设NA为阿伏伽德罗常数,下列叙述正确的是
A. 24g镁的原子量最外层电子数为NA B. 1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C. 1mol甲烷分子所含质子数为10NA D. 标准状况下,22.4L乙醇的分子数为NA
正确答案:C【解析】A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,故H+小于0.1NA,错;C项,CH4的质子数为10,正确;D项,乙醇标状下不是气体,错。
-
第2题:
下列有关阿伏加德罗常数NA的表达正确的是( )。
A.它是由意大利科学家阿伏加德罗测出来的
B.它的数值等于6.02×1023
C.它是一个有量纲的常数
D.它的单位是摩尔答案:C解析:单位物质的量的物质含有的粒子数叫阿伏加德罗常数,符号是NA,单位为mol-1,它与0.012kg12C中所含碳原子数相等,大约为6.02×1023,也就是NA约为6.02x1023mol-1。由此判断,B、D两项错误,C项正确。阿伏加德罗常数因阿莫迪欧·阿伏加德罗得名,阿伏加德罗常数的值最早是由约翰·约瑟夫·洛施米特于1865年测出,A项错误。 -
第3题:
ⅣA表示阿伏加德罗常数,则下列说法正确的是( )。 答案:B解析:
答案:B解析: -
第4题:
NA表示阿伏加德罗常数的值,下列叙述不正确的是( )。A.1 mol H2O2所含中子数为8NA
B.标准状况下,2.24 L CH4所含共价键的数目为0.4NA
C.标准状况下,2.24 L N2和CO混合气体所含电子数为1.4NA
D.1 L 0.1 mol/L CH3COOH溶液中含有的H+数小于0.1NA答案:A解析:1 mol H2O2所含中子数为16NA,A项错误。1 mol CH4含有共价键数目为4 NA,标准状况下,2.24 L CH4为0.1mol,所以其所含共价键数目为0.4 NA,B项正确。1mol N2或CO均含有14个电子,则标准状况下,2.24 L N2和CO混合气体为0.1 mol,则含有电子数为1.4NA,C项正确。醋酸为弱电解质,不能完全电离.所以0.1mol醋酸溶液中含有的氢离子数小于0.1NA,D项正确。 -
第5题:
ⅣA表示阿伏加德罗常数.下列叙述正确的是( )。A.1 mol Fel,与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol/L硫酸钾溶液中阴离子所带电荷数为ⅣA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的429混合气体中氢原子的个数为6NA答案:D解析:【知识点】化学基本概念
-
第6题:
设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.在密闭容器中.0.1 mol N2与0.3 mol H3在催化剂作用下充分反应,生成氨分子数为0.2NA个
B.标准状况下,11.2 L甲醛气体中电子数为8NA个
C.常温常压下,7.8 9苯中含有单键的数目为0.9NA
D.1 L浓度为1 mol.L-1,的Na2C03溶液中含有CO32-的数目为NA个答案:B解析:A项,氮气和氢气生成氨气是可逆反应,不能实现完全转化,不会生成0.2 mol的氨分子.A项错误;B项,标准状况下,11.2 L的甲醛气体为0.5 mol,电子数为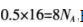 B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。
B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。 -
第7题:
下列化学史实陈述正确的是( )。A、拉瓦锡是最早使用天平的化学家
B、分子概念是由道尔顿最先提出的
C、阿伏加德罗常数是由阿伏加德罗测定出来的
D、苯分子的环状结构是由凯库勒提出的答案:D解析:拉瓦锡建立氧化学说揭开了燃烧现象的本质,他最早运用天平作为研究化学的工具,而埃及人最早使用天平.A项错误。分子概念是由意大利化学家阿伏加德罗最早提出的,B项错误。阿伏加德罗常数是由瑞典化学家J.J.贝采利乌斯测定的,C项错误。苯分子的环状结构是由凯库勒提出的,D项正确。故本题选D。 -
第8题:
阿伏加德罗常数为()。
- A、5.02×1023个碳原子数
- B、6.02×1023个碳原子数
- C、6.02×1023个氮原子数
正确答案:B -
第9题:
设NA为阿伏加德罗常数的值。下列叙述正确的是()。
- A、1mol甲醇中含有C-H键的数目为4NA
- B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
- C、标准状况下,2.24L己烷含有分子的数目为0.1NA
- D、常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
正确答案:D -
第10题:
用NA表示阿伏加德罗常数,下列叙述正确的是()。
- A、标准状况下,22.4LH2O含有的分子数为NA
- B、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA
- C、通常状况下,NA个CO2分子占有的体积为22.4L
- D、物质的量浓度为1.5mollL的MgCl2溶液中,含有Cl-数为3NA
正确答案:B -
第11题:
单选题以NA表示阿佛加德罗常数,下列说法中正确的是()A53g碳酸钠中含NA个CO32-
B0.1molOH-含NA个电子
C1.8g重水(D2O)中含NA个中子
D标准状况下11.2L臭氧中含NA个氧原子
正确答案: D解析: 暂无解析 -
第12题:
单选题设NA为阿伏加德罗常数的值。下列叙述正确的是()。A1mol甲醇中含有C-H键的数目为4NA
B25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C标准状况下,2.24L己烷含有分子的数目为0.1NA
D常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
正确答案: C解析: 1mol甲醇中含有3molC-H键,A项错误;NaOH溶液体积未知无法计算,B项错误;己烷在标准状况下为液体,不适用气体摩尔体积,C项错误;Na2O2与足量H2O反应时,生成0.2molO2,转移0.4mol电子,D项正确。 -
第13题:
阿伏伽德罗常数值6.0221367×1023mol-1为约定真值。 ( )答案:对解析: -
第14题:
NA表示阿伏加德罗常数,下列叙述正确的是( )。A.molFel2与足量氯气反应时转移的电子数为2NA
B.2L0.5mol/L硫酸钾溶液中阴离子所带电荷数为NA。
C.1 molNa202固体中含离子总数为4NA。
D.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA答案:D解析:
(1 mol Fe2+和2 mol l一)与足量氯气反应时转移的电子数为3NA,A项错误;B项,2 L 0.5 mol/L硫酸钾溶液中含溶质(K2S0。)的物质的量是l mol,所以阴离子S042-的物质的量是l mol,所带电荷数为2NA,B项错误;C项,Na202是由Na+和O22-一构成,所以l mol Na2O2固体中含离子总数是3 mol,含离子总数为3NA。,C项错误;D项,丙烯和环丙烷的最简式都是CH2,则42g混合气体含有3 mol CH2,则氢原子的物质的量是6 mol,个数为6NA,D项正确。故选D。 -
第15题:
设ⅣA为阿伏加德罗常数的值,下列说法正确的是( )。 答案:D解析:
答案:D解析:

-
第16题:
设NA为阿伏加德罗常数的值,下列说法正确的是()。
A.标准状况下,NA个SO3分子的体积约为22.4 L
B.常温常压下,2 mol氦气所具有的原子数目为2NA
C.1L 0.2 mol·L-1的Na2S溶液中,S2-的数目为0.2NA
D.1mol Cl2与足量的Fe完全反应转移的电子数目为3NA答案:B解析:标准状况下,SO3是固体,不能用标准状况下的气体摩尔体积进行计算,A项错误;因为氦气为单原子分子,所以2 mol氦气含有的原子数为2NA,B项正确;S2-在溶液中发生水解,所以l L 0.2 mol/L的Na2S溶液中S2-的数目小于0.2NA,C项错误;氯气单质是强氧化剂,能将变价金属氧化到高价态,铁与氯气反 应.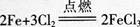 铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。
铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。 -
第17题:
设NA为阿伏加德罗常数的值,下列有关叙述正确的是()。
A.标准状况下,2.24L H2O含有的氧原子数为0.1NA。
B.常温下,14g N2中的氮原子数为0.5NA。
C.2 L 0.5 mol/L亚硫酸溶液中含有的氢离子数为2NA。
D.23gNa在空气中充分燃烧时,转移电子数为NA。答案:D解析:标准状况下H2O为液态,所以标准状况下,2.24 L H2O含有的氧原子数不是0.1NA。常温下,14 g N2中的氮原子数为NA。由于亚硫酸是弱酸,所以2 L 0.5mol/L亚硫酸溶液中含有的氢离子数小于2NA。 -
第18题:
NA为阿伏加德罗常数的值。下列说法正确的是( ) 答案:C解析:
答案:C解析:
-
第19题:
设NA为阿伏加德罗常数的数值,下列叙述正确的是( )。 答案:A解析:A项,利用原子守恒,可推知氮原子数为0.2NA,A正确;B项,一个羟基中电子数为9,
答案:A解析:A项,利用原子守恒,可推知氮原子数为0.2NA,A正确;B项,一个羟基中电子数为9,
-
第20题:
NA为阿伏加德罗常数,下列对0.3mol/L的22SO4溶液的说法中,正确的是()
- A、1L溶液中含0.3NA个钾离子
- B、1L溶液中含0.9NA个离子(K+、SO42-)
- C、2L溶液中钾离子浓度是1.2mol/L
- D、2L溶液中含0.6NA个离子(K+、SO42-)
正确答案:B -
第21题:
NA为阿伏加德罗常数,下列关于0.2mol/LK2SO4溶液的正确说法是()
- A、500mL溶液中所含K+、SO42-总数为0.3NA
- B、500mL溶液中含有0.1NA个K+离子
- C、1L溶液中K+离子浓度是0.2mol/L
- D、2L溶液中SO42-离子浓度是0.4mol/L
正确答案:A -
第22题:
设N为阿伏加德罗常数的值,下列叙述正确的是()。
- A、1mol氯气参加氧化还原反应,转移的电子数一定为2NA
- B、25℃时,1LpH=12的Na2CO3溶液中含有Na的数目为0.02NA
- C、12g石墨和C60的混合物中质子总数一定为6NA
- D、常温常压下,22.4L乙烯中C-H键数为4NA
正确答案:C -
第23题:
单选题NA表示阿伏伽德罗常数,下列叙述正确的是()。A等物质的量的N2和CO所含分子数均为NA
B标准状况下,2.24L戊烷所含分子数为0.1NA
C1molNa2O2固体中含离子总数为4NA
D1.7gH2O2中含有的电子数为0.9NA
正确答案: B解析: 1.7gH2O2为0.05mol,每个分子含有18个电子,因此所含电子数为0.9NA。 -
第24题:
多选题下列说法正确的是(NA为阿伏加德罗常数)()A124gP4含有p—P键的个数为4NA
B12g石墨中含有C—C键的个数为1.5NA
C12g金刚石中含有C—C键的个数为2NA
D60gSi02中含Si—O键的个数为2NA
正确答案: A,D解析: 暂无解析
