单选题将0.2mol·L-1的醋酸与0.2mol·L-1醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为( )。(其中,Ka=1.76×10-5)A 6∶1B 4∶1C 5∶1D 10∶1
题目
6∶1
4∶1
5∶1
10∶1
相似考题
参考答案和解析
根据缓冲溶液H+浓度近似计算公式,pH=pKa-lg(cHAc/cNaAc)=4.75-lg(cHAc/cNaAc)=4.05,解得:cHAc/cNaAc=5.0,即cHAc/cNaAc=5∶1。
更多“将0.2mol·L-1的醋酸与0.2mol·L-1醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为( ”相关问题
-
第1题:
已知KSP(PbBr2)=4.6×10-6,将0.2mol·L-1Pb(NO3)2溶液与0.2mol·L-1的NaBr溶液等体积混合,由此推断下列结论正确的是( )。A 混合溶液中有PbBr2沉淀出现
B 混合溶液中无PbBr2沉淀出现
C 反应完成时,反应熵Q<KSP
D 反应完成时,反应熵KSP<Q答案:A解析: ,溶液中(Br-)=2.3×10-5mol·L-1<0.2mol·L-1,故有PbBr2沉淀出现
,溶液中(Br-)=2.3×10-5mol·L-1<0.2mol·L-1,故有PbBr2沉淀出现 -
第2题:
下列比较中,正确的是()。
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN
B.物质的量浓度相等的H2S和NaHS混合溶液中: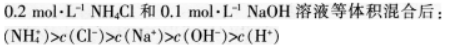
C.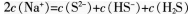
D.将①0.01mol·L-1的CH3COOH溶液;②0.01mol·L-1的盐酸;③pH=12的氨水;④pH=12的NaOH溶液稀释相同倍数后溶液的pH:③>④>②>①答案:B解析:同温和同物质的量浓度时,HF比HCN易电离,这说明HF的酸性强于HCN,酸性越弱,相应的钠盐越容易水解.所得溶液碱性越强.DH越大.则溶液DH:NaF<NaCN.A项错误:根据物料守恒可知,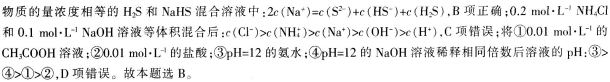
-
第3题:
求0.2mol/L H2SO4溶液的pH值。
正确答案:因为H2SO4→2H++SO42-
则0.2mol/L H2SO4溶液的[H+]为0.2×2=0.4(mol/L)
溶液的pH值计算如下
pH=-lg[H+]=-lg0.4=0.40
溶液的pH值为0.40。 -
第4题:
将0.1mol/L的NaOH溶液与0.2mol/L的HAC溶液等体积混合,混合溶液具有缓冲作用。
正确答案:正确 -
第5题:
使红细胞发生溶血的溶液是()。
- A、0.2mol•L-1NaCl
- B、0.1mol•L-1葡萄糖
- C、0.3mol•L-1葡萄糖
- D、0.4mol•L-1NaCl
正确答案:B -
第6题:
将0.2mol/L的醋酸与0.2mol/L醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为(K=1.76×10-5):()
- A、6:1
- B、4:1
- C、5:1
- D、10:1
正确答案:C -
第7题:
将0.2mol/LHA(Ka=1.0×10-5)与0.2mol/LHB(Ka=1.0×10-9)等体积混合,混合后溶液的pH为()。
- A、3.00
- B、3.15
- C、3.30
- D、4.15
正确答案:A -
第8题:
已知298K时浓度为0.010mol·L-1的某一元弱酸溶液的pH为4.00,则该酸的解离常数等于1.0*10-6;将该酸溶液稀释后,其pH将变大,解离度α将变大,其KaΘ将()。
正确答案:不变 -
第9题:
把醋酸钠晶体加到1升0.1mol•L-1的醋酸溶液中将会产生:()
- A、K°平衡值增加
- B、K°平衡值减小
- C、pH值增加
- D、[Na+]浓度增加
- E、[Na+]浓度不变
正确答案:C -
第10题:
将0.2mol/L的醋酸(Ka=l.8×10-5)与0.2mol/L醋酸钠溶液混合,为使溶液的pH维持在4.05,则酸和盐的比例应为()。
- A、6:1
- B、4:1
- C、5:1
- D、10:1
正确答案:C -
第11题:
问答题用玻璃电极作指示电极,以0.2mol·L-1的氢氧化钠溶液电位滴定0.0200mol·L-1的苯甲酸溶液,从滴定曲线上求得终点时溶液的pH为8.22,二分之一终点时溶液的pH为4.18,试计算苯甲酸的离解常数。正确答案: 设HA为苯甲酸,其解离常数Ka=c(H3O+)c(A-)/c(HA)
二分之一终点时,c(HA)=c(A-)/Ka=c(H3O+)
PKa=pH=4.18 Ka=6.6×10-5
苯甲酸的离解常数Ka=6.6×10-5。解析: 暂无解析 -
第12题:
单选题将0.2mol/L的醋酸与0.2mol/L醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为(K=1.76×10-5):()A6:1
B4:1
C5:1
D10:1
正确答案: C解析: 暂无解析 -
第13题:
将0. 2mol/L的醋酸与0. 2mol/L醋酸钠溶液混合,为使溶液pH值维持在4. 05,则酸和盐的比例应为(Ka = 1.76X10-5):A. 6:1
B. 4 : 1
C. 5 : 1
D. 10 : 1答案:C解析:提示:酸性缓冲溶液的pH值与Ka的关系为 。
。 -
第14题:
将0.2mol/L的醋酸(Ka=1.8×10-5)与0.2mol/L醋酸钠溶液混合,为使溶液的pH值维持在4.05,则酸和盐的比例应为( )。
A. 6:1 B. 4:1 C. 5:1 D. 10:1答案:C解析: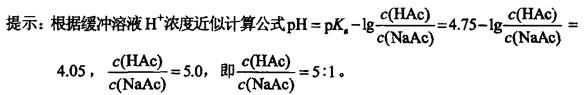
-
第15题:
使0.2mol·L-1HNO3溶液100mL的pH值增加到7,需加入固体NaOH()克,使0.2mol·L-1HAc溶液100mL的pH值增加到7需加入固体NaOH比上述硝酸要()(多,少或相等)
正确答案:0.8;少 -
第16题:
将0.10mol·L-1的NaAc溶液加水稀释一倍,溶液的pH值变小。
正确答案:正确 -
第17题:
0.2mol•L-1的下列溶液中渗透压最大的是()。
- A、NaCl
- B、CaCl2
- C、葡萄糖
- D、AlCl3
正确答案:D -
第18题:
下列混合溶液是否具有缓冲作用?为什么? (1)0.1mol·L-1的KH2PO4溶液50ml与0.1 mol·L-1Na2HPO4溶液50ml混合。 (2)0.2mol·L-1的HAc溶液50ml与0.2 mol·L-1的NaOH溶液25ml混合。 (3)0.1mol·L-1的NH3·H2O溶液50ml与0.2 mol·L-1的HCl溶液25ml混合。 (4)0.1mol·L-1的HCl溶液50ml与0.1 mol·L-1的KCl溶液10ml混合。 (5)1×10-3mol·L-1的HAc溶液50ml与1×10-3mol·L-1的NaAc溶液50ml混合。
正确答案: (1)(2)(4)具有缓冲作用,(3)(5)无缓冲作用。因为(1)(2)中存在着足够浓度的共轭酸碱对,(4)是pH<3的强酸,(3)(5)中无足够浓度的共轭酸碱对。 -
第19题:
将0.2mol·L-1HAc溶液55.0mL与0.2mol·L-1NaOH溶液5.0mL混合,(HAc的pKa=4.75)则混合溶液的pH为()。
- A、8.88
- B、7
- C、3.75
- D、1.77
正确答案:C -
第20题:
试用HAc和NaAc设计一缓冲溶液,其pH值为: (1)4.00; (2)5.00, 问HAc及NaAc的浓度各为多少?假定酸与盐的总浓度为1.0mol•L-1。(已知Ka=1.76×10-5)
正确答案: (1)HAc:NaAc=0.85:0.15;
(2)HAc:NaAc=0.36:0.64 -
第21题:
用玻璃电极作指示电极,以0.2mol·L-1的氢氧化钠溶液电位滴定0.0200mol·L-1的苯甲酸溶液,从滴定曲线上求得终点时溶液的pH为8.22,二分之一终点时溶液的pH为4.18,试计算苯甲酸的离解常数。
正确答案: 设HA为苯甲酸,其解离常数Ka=c(H3O+)c(A-)/c(HA)
二分之一终点时,c(HA)=c(A-)/Ka=c(H3O+)
PKa=pH=4.18 Ka=6.6×10-5
苯甲酸的离解常数Ka=6.6×10-5。 -
第22题:
单选题0.2mol•L-1的下列溶液中渗透压最大的是()。ANaCl
BCaCl2
C葡萄糖
DAlCl3
正确答案: A解析: 暂无解析 -
第23题:
单选题将0.2mol·L-1的醋酸与0.2mol·L-1醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为( )。(其中,Ka=1.76×10-5)A6∶1
B4∶1
C5∶1
D10∶1
正确答案: A解析:
根据缓冲溶液H+浓度近似计算公式,pH=pKa-lg(cHAc/cNaAc)=4.75-lg(cHAc/cNaAc)=4.05,解得:cHAc/cNaAc=5.0,即cHAc/cNaAc=5∶1。 -
第24题:
单选题将0.2mol/L的醋酸(Ka=l.8×10-5)与0.2mol/L醋酸钠溶液混合,为使溶液的pH维持在4.05,则酸和盐的比例应为()。A6:1
B4:1
C5:1
D10:1
正确答案: A解析: 暂无解析
