无菌分装工艺中存在的问题主要有装量差异、()、无菌问题、吸潮问题等。
题目
无菌分装工艺中存在的问题主要有装量差异、()、无菌问题、吸潮问题等。
相似考题
更多“无菌分装工艺中存在的问题主要有装量差异、()、无菌问题、吸潮问题”相关问题
-
第1题:
眼用液体型制剂的工艺流程为
A.原辅料一配滤一灭菌一无菌分装一质检一印字包装
B.原辅料一灭菌一配滤一无菌分装一质检一印字包装
C.原辅料一灭菌一配滤一质检一无菌分装一印字包装
D.原辅料一配滤一灭菌一质检一无菌分装一印字包装
E.原辅料一配滤一灭菌一无菌分装一印字包装一质检
正确答案:A
眼用液体型制剂的工艺流程:原辅料一配滤一灭菌一无菌分装一质检一印字包装。所以答案为A。 -
第2题:
眼用液体型制剂的工艺流程为
A、原辅料-配滤-灭菌-无菌分装-质检-印字包装
B、原辅料-灭菌-配滤-无菌分装-质检-印字包装
C、原辅料-灭菌-配滤-质检-无菌分装-印字包装
D、原辅料-配滤-灭菌-质检-无菌分装-印字包装
E、原辅料-配滤-灭菌-无菌分装-印字包装-质检
参考答案:A
-
第3题:
A.干燥、疏松、混合均匀、色泽一致
B.9.0%
C.10.0%
D.无菌
E.粒度、外观均匀度、水分、装量差异、装量、无菌、微生物限度眼用散剂应答案:D解析:本题考点是散剂的质量要求。散剂生产与贮藏应符合下列有关规定:散剂应干燥、疏松、混合均匀、色泽一致。散剂质量检查项目与要求:①粒度用于烧伤或严重创伤的外用散剂,按照《中国药典》粒度和粒度分布测定法测定,除另有规定外,通过七号筛的粉末总量不得少于95%;②外观均匀度:取供试品适量,置光滑纸上,平铺约5cm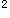 ,将其表面压平,在明亮处观察,应色泽均匀,无花纹与色斑。③水分:按照《中国药典》水分测定法测定,除另有规定外不得过9.0%。④装量差异:单剂量包装的散剂,应取供试品10袋(瓶),分别称定每袋(瓶)内容物重量,每袋(瓶)装量与标示量相比较,超出限度的不得多于2袋(瓶),并不得有1袋(瓶)超出限度1倍。⑤装量:多剂量包装的散剂,按照
,将其表面压平,在明亮处观察,应色泽均匀,无花纹与色斑。③水分:按照《中国药典》水分测定法测定,除另有规定外不得过9.0%。④装量差异:单剂量包装的散剂,应取供试品10袋(瓶),分别称定每袋(瓶)内容物重量,每袋(瓶)装量与标示量相比较,超出限度的不得多于2袋(瓶),并不得有1袋(瓶)超出限度1倍。⑤装量:多剂量包装的散剂,按照 中国药典》通则最低装量检查法检查。⑥无菌:用于烧伤或严重创伤的外用散剂应进行无菌检查,按照《中国药典》通则无菌检查法检查,应符合规定;⑦微生物限度除另有规定外,按照《中国药典》通则非无菌药品微生物限度检查法检查,应符合规定。
中国药典》通则最低装量检查法检查。⑥无菌:用于烧伤或严重创伤的外用散剂应进行无菌检查,按照《中国药典》通则无菌检查法检查,应符合规定;⑦微生物限度除另有规定外,按照《中国药典》通则非无菌药品微生物限度检查法检查,应符合规定。 -
第4题:
眼用液体型制剂的工艺流程为A.原辅料-配滤-灭菌-无菌分装-质检-印字包装
B.原辅料-灭菌-滤-菌分装-检-印字包装
C.原辅料-灭菌-配滤-质检-无菌分装-印字包装
D.原辅料-配滤-灭菌-质检-无菌分装-印字包装
E.原辅料-配滤-灭菌-无菌分装-印字包装-质检答案:A解析:眼用液体型制剂的工艺流程:原辅料-配滤-灭菌-无菌分装-质检-印字包装。所以答案为A。 -
第5题:
简述无菌分装工艺中容易出现哪些问题?
正确答案:1.装量差异:药粉因吸潮而粘性增加,导致流动性下降,药粉的物理性质如晶形,粒度,比容及机械设备性能等因素影响装量差异。
2.澄明度问题:采用无菌分装工艺后,药物经过多道生产工序,以致污染机会增多,使澄明度不合要求。
3.无菌度问题:成品无菌检查属抽查,不能代表全部产品完全无菌,为了保证安全用药,解决无菌分装过程中的污染问题,宜采用层流净化装臵。
4.贮存过程中吸潮变质:这种情况多见于瓶装无菌粉末,原因之一是由于密封不严、天然橡胶塞的透气性所致。 -
第6题:
无菌分装工艺中存在的问题不包括()
- A、渗透压问题
- B、装量差异
- C、无菌度问题
- D、澄明度问题
- E、贮存过程中吸潮变质
正确答案:A -
第7题:
无菌制剂输液存在的主要问题是()
- A、染菌
- B、热原反应
- C、澄明度
- D、微粒异物问题
正确答案:A,B,C,D -
第8题:
无菌分装药物的()、粒度、吸潮以及含水量偏高等均会影响其流动性,从而影响装置。
正确答案:晶态 -
第9题:
眼用液体型制剂的工艺流程为()
- A、原辅料-配滤-灭菌-无菌分装-质检-印字包装
- B、原辅料-灭菌-滤-菌分装-检-印字包装
- C、原辅料-灭菌-配滤-质检-无菌分装-印字包装
- D、原辅料-配滤-灭菌-质检-无菌分装-印字包装
- E、原辅料-配滤-灭菌-无菌分装-印字包装-质检
正确答案:A -
第10题:
填空题无菌分装药物的()、粒度、吸潮以及含水量偏高等均会影响其流动性,从而影响装置。正确答案: 晶态解析: 暂无解析 -
第11题:
多选题无菌制剂输液存在的主要问题是()A染菌
B热原反应
C澄明度
D微粒异物问题
正确答案: B,C解析: 暂无解析 -
第12题:
单选题眼用液体型制剂的工艺流程为()A原辅料-配滤-灭菌-无菌分装-质检-印字包装
B原辅料-灭菌-滤-菌分装-检-印字包装
C原辅料-灭菌-配滤-质检-无菌分装-印字包装
D原辅料-配滤-灭菌-质检-无菌分装-印字包装
E原辅料-配滤-灭菌-无菌分装-印字包装-质检
正确答案: B解析: 眼用液体型制剂的工艺流程:原辅料-配滤-灭菌-无菌分装-质检-印字包装。所以答案为A。 -
第13题:
主药性质稳定的滴眼剂的制备工艺流程为( )。
A.主药、附加剂→溶解→滤过→灭菌→无菌分装→质检→包装
B.主药、附加剂→搅拌→溶解→灭菌→无菌分装→质检→包装
C.主药、附加剂→灭菌→溶解→滤过→无菌分装→质检→包装
D.主药、附加剂→粗滤→精滤→灭菌→无菌分装→质检→包装
E.主药、附加剂→溶解→灭菌→滤过→无菌分装→质检→包装
正确答案:A
-
第14题:
下列因素属于造成注射用无菌分装粉针剂装量差异不合格的原因是A:物料粒度太小
B:瓶塞密封不严
C:物料吸潮
D:物料含水量过高
E:药物的晶形不好答案:B,C,D,E解析:本题考查注射用无菌分装工艺中存在的问题。药粉因吸潮而黏性增加,导致流动性下降,药粉的物理性质如晶形、粒度、比容及机械设备性能等因素均能影响装量差异。故本题答案应选BCDE。 -
第15题:
A.干燥、疏松、混合均匀、色泽一致
B.9.0%
C.10.0%
D.无菌
E.粒度、外观均匀度、水分、装量差异、装量、无菌、微生物限度散剂的外观答案:A解析:本题考点是散剂的质量要求。散剂生产与贮藏应符合下列有关规定:散剂应干燥、疏松、混合均匀、色泽一致。散剂质量检查项目与要求:①粒度用于烧伤或严重创伤的外用散剂,按照《中国药典》粒度和粒度分布测定法测定,除另有规定外,通过七号筛的粉末总量不得少于95%;②外观均匀度:取供试品适量,置光滑纸上,平铺约5cm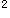 ,将其表面压平,在明亮处观察,应色泽均匀,无花纹与色斑。③水分:按照《中国药典》水分测定法测定,除另有规定外不得过9.0%。④装量差异:单剂量包装的散剂,应取供试品10袋(瓶),分别称定每袋(瓶)内容物重量,每袋(瓶)装量与标示量相比较,超出限度的不得多于2袋(瓶),并不得有1袋(瓶)超出限度1倍。⑤装量:多剂量包装的散剂,按照
,将其表面压平,在明亮处观察,应色泽均匀,无花纹与色斑。③水分:按照《中国药典》水分测定法测定,除另有规定外不得过9.0%。④装量差异:单剂量包装的散剂,应取供试品10袋(瓶),分别称定每袋(瓶)内容物重量,每袋(瓶)装量与标示量相比较,超出限度的不得多于2袋(瓶),并不得有1袋(瓶)超出限度1倍。⑤装量:多剂量包装的散剂,按照 中国药典》通则最低装量检查法检查。⑥无菌:用于烧伤或严重创伤的外用散剂应进行无菌检查,按照《中国药典》通则无菌检查法检查,应符合规定;⑦微生物限度除另有规定外,按照《中国药典》通则非无菌药品微生物限度检查法检查,应符合规定。
中国药典》通则最低装量检查法检查。⑥无菌:用于烧伤或严重创伤的外用散剂应进行无菌检查,按照《中国药典》通则无菌检查法检查,应符合规定;⑦微生物限度除另有规定外,按照《中国药典》通则非无菌药品微生物限度检查法检查,应符合规定。 -
第16题:
当前输液生产存在的主要问题是()。
- A、装量差异超限
- B、细菌污染
- C、热原反应
- D、澄明度问题
正确答案:B,C,D -
第17题:
滴眼剂的制备流程为:()
- A、药物+附加剂-溶解-滤过-灭菌-无菌分装-质检-包装
- B、药物+附加剂-滤过-灭菌-无菌分装-质检-包装
- C、药物+附加剂-灭菌-无菌分装-质检-包装
- D、药物+附加剂-质检-滤过-灭菌-无菌分装-溶解-包装
- E、药物+附加剂-溶解-滤过-无菌分装-灭菌-质检-包装
正确答案:A -
第18题:
注射用无菌粉末依据生产工艺的不同,分为注射用无菌粉末直接分装制品和() 。
正确答案:注射用冻干无菌粉末制品 -
第19题:
无菌分装工艺中存在的问题主要有装量差异、()、无菌问题、吸潮问题等。
正确答案:澄明度问题 -
第20题:
原申报的工艺为大盘冻干或溶媒结晶后再无菌分装,现改成冻干(瓶冻)工艺,应该讲无菌保证水平有提高,现在CDE对这类工艺变更的审评要求?
正确答案:首先应该按照《药品注册管理办法》附件4要求,进行工艺变更的补充申请,同时参照《上市后化学药品变更研究的技术指导原则》进行工艺变更的研究和验证,提交相应的研究资料。CDE对这类工艺变更的审评与其他变更申请的技术要求一致,任何变更应对产品的安全性、有效性、质量不产生负面的影响,对无菌产品还应关注无菌保证水平不能降低。 -
第21题:
填空题注射用无菌粉末依据生产工艺的不同,分为注射用无菌粉末直接分装制品和() 。正确答案: 注射用冻干无菌粉末制品解析: 暂无解析 -
第22题:
单选题滴眼剂的制备流程为:()A药物+附加剂-溶解-滤过-灭菌-无菌分装-质检-包装
B药物+附加剂-滤过-灭菌-无菌分装-质检-包装
C药物+附加剂-灭菌-无菌分装-质检-包装
D药物+附加剂-质检-滤过-灭菌-无菌分装-溶解-包装
E药物+附加剂-溶解-滤过-无菌分装-灭菌-质检-包装
正确答案: D解析: 暂无解析 -
第23题:
单选题无菌分装工艺中存在的问题不包括()A渗透压问题
B装量差异
C无菌度问题
D澄明度问题
E贮存过程中吸潮变质
正确答案: E解析: 暂无解析 -
第24题:
填空题无菌分装工艺中存在的问题主要有装量差异、()、无菌问题、吸潮问题等。正确答案: 澄明度问题解析: 暂无解析
