某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?
题目
某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?
相似考题
更多“某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8t(H2SO4的质量分数为20%),与足量 ”相关问题
-
第1题:
有一Fe和Fe0的混合物,测得其中铁元素的质量分数为80%o取该混合物7.Og,加足量稀硫酸完全溶解,生成硫酸亚铁的质量为( )g。
A.7.6
B.15.2
C.20.O
D.40.O
正确答案:B
-
第2题:
双硫腙比色法测定铅时产生的废氰化钾溶液,在排放前应加入( )降低毒性。
A.氢氧化钠和硫酸亚铁
B.盐酸和硫酸亚铁
C.氢氧化钠
D.盐酸
正确答案:A
-
第3题:
下列关于工业废汽利用系统说法错误的是( )。A.机械工厂锻工车间蒸汽锻锤的废汽,其压力为0.04~0.06MPa
B.机械工厂锻工车间蒸汽锻锤的废汽,其温度为120℃左右
C.锻锤废汽中含有少量的杂质及油,在利用废汽前必须经填料分离器及油分离器进行处理
D.废汽凝结水经过活性炭过滤器处理后,其各项技术指标符合锅炉给水质量标准后,才能送至锅炉房的补水箱中答案:B解析: -
第4题:
100g某硫酸恰好与13g锌完全起反应。试计算这种硫酸中溶质的质量分数。
解:设这种硫酸中溶质的质量为X。 Zn+H2SO4=ZnSO4+H2↑ 65 98 13g x 65/13g=98/x X=19.6g 19.6/100×100%=19.6% 答:这种硫酸铜中溶质的质量分数为19.6%。 -
第5题:
一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量.答案:解析:题目中涉及的化学反应如下: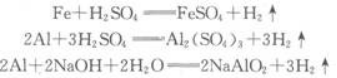

答:原混合物中铝的质量为5.4g,铁的质量为5.6g.
